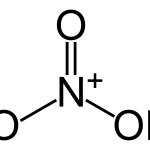
Cấu trúc phân tử của axit nitric: Công thức hóa học (công thức phân tử): HNO3, công thức cấu tạo: HO-NO2. HNO3 là phân tử phân cực được hình thành bởi các liên kết phân cực nên dễ tan trong nước, các phân tử được kết hợp với nhau bằng lực van der Waals và chúng là những tinh thể phân tử ở trạng thái rắn.
Các tính chất vật lý và hóa học của axit nitric:
Tính chất vật lý
Axit nitric tinh khiết là chất lỏng nhờn không màu, bốc khói khi mở nắp, axit dễ bay hơi [nhiệt độ sôi thấp → dễ bay hơi → sương mù axit].
Điểm nóng chảy: -42 ° C, điểm sôi: 83 ° C. Mật độ: 1,5 g / cm3, có thể hòa tan với nước theo bất kỳ tỷ lệ nào, 98% axit nitric là axit nitric bốc khói và hơn 69% axit nitric là axit nitric đậm đặc.
Tính chất hóa học
Nó có một số đặc điểm chung của axit: ví dụ khi sinh ra khí CO2 trong phòng thí nghiệm, nếu không có axit clohiđric loãng có thể dùng axit nitric loãng thay thế.
Không bền: HNO3 bị phân hủy khi tiếp xúc với ánh sáng hoặc nhiệt, HNO3 càng đặc thì càng dễ bị phân hủy. NO2 được giải phóng từ sự phân ly của axit nitric hòa tan trong nó làm cho axit nitric có màu vàng.
Tính oxi hóa mạnh: Cả HNO3 loãng và HNO3 đặc đều có tính oxi hóa mạnh, HNO3 có nồng độ càng lớn thì tính oxi hóa càng mạnh. Tính chất oxy hóa của nó được thể hiện ở các khía cạnh sau:
- Có thể phản ứng với hầu hết các kim loại (trừ Hg và Au). Khi HNO3 phản ứng với kim loại, mức độ khử của HNO3 (tức là mức độ giảm hóa trị của nitơ) phụ thuộc vào nồng độ của axit nitric và độ bền của tính khử của kim loại nguyên tố. Đối với cùng một nguyên tố kim loại, nồng độ của HNO3 càng nhỏ thì mức độ khử của HNO3 càng lớn, và tính khử của nitơ càng lớn. Định luật phản ứng tổng quát là:
- Kim loại + HNO3 (đặc) → Nitrat + NO2 ↑ + H2O
- Kim loại + HNO3 (loãng) → Nitrat + NO ↑ + H2O
- Kim loại hoạt động hơn (như Mg, Zn, v.v.) + HNO3 (cực hiếm) → nitrat + H2O + N2O ↑ (hoặc NH3, v.v.)
Các ví dụ quan trọng về phản ứng của kim loại với axit nitric là:
+ Phản ứng xảy ra tương đối chậm, dung dịch sau phản ứng chuyển sang màu xanh lam, khí không màu sinh ra sau phản ứng chuyển thành màu nâu đỏ sau khi gặp không khí (NO không màu bị không khí oxi hóa thành NO2 màu nâu đỏ). Các phòng thí nghiệm thường sử dụng phản ứng này để tạo ra khí NO.
+ Phản ứng tương đối dữ dội và khí màu nâu đỏ được tạo ra trong quá trình phản ứng. Ngoài ra, khi phản ứng xảy ra, nồng độ axit nitric loãng dần, và khí sinh ra sau phản ứng là hỗn hợp khí NO2 và NO.
- Ở nhiệt độ thường, HNO3 đặc có thể thụ động hóa kim loại Fe và Al, đồng thời oxi hóa bề mặt của Fe và Al tạo thành màng oxit mỏng và đặc. Do đó, bạn có thể dùng bình bằng sắt hoặc nhôm để đựng axit nitric đặc nhưng cần chú ý đậy kín để tránh axit nitric phản ứng với sắt, nhôm sau khi bay hơi và loãng. (Tương tự như axit sunfuric đặc)
- Hỗn hợp gồm HNO3 đặc và axit clohiđric đặc theo tỉ lệ thể tích 1: 3 được gọi là nước cường toan. Nước cường toan có khả năng hòa tan kim loại mạnh hơn, có thể hòa tan kim loại Pt và Au.
- Nó có thể oxi hóa nhiều nguyên tố phi kim (như C, S, P,…) để tạo ra oxiaxit hóa trị cao nhất hoặc oxit phi kim loại hóa trị cao nhất.
Phương trình hóa học:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
P + 5HNO3 → H3PO4 + 5NO2 + H2O