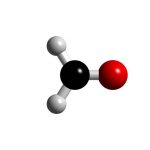
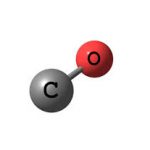
Formaldehyde là một hóa chất hữu cơ có công thức hóa học là HCHO hoặc CH₂O và trọng lượng phân tử là 30,03 còn được gọi là formic. Formaldehyde là một loại khí không màu và có tính kích ứng, gây khó chịu cho mắt và mũi của con người.
Tỷ trọng tương đối của khí là 1,067 (không khí = 1), và tỷ trọng của chất lỏng là 0,815g / cm³ (-20 ℃). Điểm nóng chảy -92 ° C, điểm sôi -19,5 ° C. Hòa tan trong nước và etanol. Nồng độ của dung dịch nước có thể lên tới 55%, nói chung là 35% -40%, thường là 37%, được gọi là formalin.
Formaldehyde có tính khử, đặc biệt trong dung dịch kiềm thì khả năng khử càng mạnh. Có thể cháy, hơi nước và không khí tạo thành hỗn hợp nổ, giới hạn nổ là 7% -73% (thể tích), và điểm bắt lửa khoảng 300 ℃.
Formaldehyde có thể thu được bằng cách khử hydro hoặc oxy hóa metanol dưới sự xúc tác của các kim loại như bạc và đồng, nó cũng có thể được tách ra khỏi các sản phẩm oxy hóa của hydrocacbon.
Nó có thể được sử dụng làm nguyên liệu cho nhựa phenolic, nhựa urê-formaldehyde, vinylon, urotropine, pentaerythritol, thuốc nhuộm, thuốc trừ sâu và chất khử trùng. Dung dịch formaldehyde công nghiệp thường chứa 37% formaldehyde và 15% metanol là chất ức chế quá trình trùng hợp, điểm sôi là 101 ℃.
Formaldehyde thường là chất khí không màu, mùi hắc. Nó dễ dàng hòa tan trong nước và ete, và nồng độ của dung dịch nước có thể lên đến 55%. Nó có thể trộn lẫn với các dung môi hữu cơ như etanol và axeton theo bất kỳ tỷ lệ nào và không hòa tan trong ete dầu mỏ. Chất lỏng dễ bị đục khi để lâu khi gặp lạnh, khi gặp nhiệt độ thấp sẽ tạo thành kết tủa paraformaldehyde.
Tính chất hóa học của Formaldehyde là rất hoạt động. Dưới sự xúc tác của kim loại hoặc oxit kim loại dễ bị khử thành metanol, khi bị oxi hóa có thể tạo ra axit fomic hoặc cacbon đioxit và nước. Formaldehyde là chất khử mạnh, có tính khử mạnh hơn khi có tính kiềm nhẹ và có thể bị oxy hóa chậm thành axit fomic trong không khí.
Bản thân Formaldehyde có thể trải qua phản ứng ngưng tụ. Trùng ngưng anđehit với anđehit và xeton. Nó dễ dàng bị ngưng tụ với amoniac hoặc các hợp chất của amin, chẳng hạn như phản ứng với amoniac để tạo thành urotropine, và ngưng tụ với urê để tạo thành dimethylolurea. Formaldehyde được ngưng tụ với khí tổng hợp để tạo ra ethylene glycol.
Keo dán là lĩnh vực tiêu thụ formaldehyde quan trọng nhất ở nước tôi và lượng tiêu thụ này chiếm tỷ trọng lớn nhất, chiếm khoảng 40% tổng lượng tiêu thụ. Các sản phẩm kết dính chính được sản xuất là keo dán nhựa urê-fomanđehit, keo dán nhựa phenolic và keo dán nhựa melamine-fomanđehit, chủ yếu được sử dụng làm chất xử lý cho chế biến gỗ, hợp chất đúc, chất phủ, dệt và giấy.
Paraformaldehyde là nguyên liệu chính để sản xuất thuốc diệt cỏ glyphosate, acetochlor, butachlor, oxacamine, v.v. và thuốc trừ sâu như tricyclazole. Ngoài ra, paraformaldehyde cũng cho thấy tiềm năng lớn trong việc thay thế formaldehyde công nghiệp.
MDI (diphenylmethane diisocyanate) là một trong những nguyên liệu chính để sản xuất các sản phẩm polyurethane và được sử dụng rộng rãi trong sản xuất các sản phẩm xốp cứng PU (polyurethane). Là một nguyên liệu thô thiết yếu trong sản xuất da, MDI có thể làm chắc da.
Phản ứng hóa học:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + 8 HCHO → 2 C6H5COOH + 5 H2O