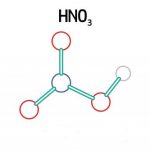
Axit nitric (tên tiếng Anh: Nitric acid) là một axit vô cơ đơn bazơ có tính oxi hóa mạnh và ăn mòn. Đây là một trong sáu axit vô cơ mạnh và là nguyên liệu hóa học quan trọng. Công thức hóa học của nó là HNO₃ và trọng lượng phân tử là 63,01.
Axit nitric thường được gọi là nước nitrat hoặc nước nitơ amoniac.
Trong công nghiệp, nó có thể được sử dụng để làm phân bón, thuốc trừ sâu, thuốc nổ, thuốc nhuộm, v.v … trong hóa hữu cơ, hỗn hợp axit nitric đậm đặc và axit sunfuric đặc là một thuốc thử nitrat hóa quan trọng.
Axit nitric tinh khiết là một chất lỏng không màu và trong suốt, còn axit nitric đậm đặc là một chất lỏng màu vàng nhạt (có hòa tan nitơ đioxit). Trong trường hợp bình thường, nó là một chất lỏng không màu và trong suốt, có mùi khó chịu.
Axit nitric đậm đặc có hàm lượng khoảng 68% và dễ bay hơi, tạo ra sương trắng trong không khí (giống như axit clohydric đậm đặc). Nó là một axit nitric nhỏ được hình thành do sự kết hợp của hơi axit nitric (nói chung là nitơ đioxit bị phân hủy bởi axit nitric đặc) và hơi nước.
Tỷ trọng tương đối là 1,41, điểm nóng chảy là -42 ° C (khan) [4], điểm sôi là 83 ° C (khan). Đối với axit nitric loãng, thường được coi là ranh giới giữa nồng độ và loãng là 6mol / L.
Nồng độ của axit nitric cấp thuốc thử thông thường có bán trên thị trường là khoảng 68%, trong khi nồng độ của axit nitric đậm đặc loại công nghiệp là 98%, và nồng độ của axit nitric bốc khói thường là khoảng 98%.
Phân tử axit nitric là một phân tử cộng hóa trị phẳng, nguyên tử nitơ trung tâm được lai hóa sp2, và một obitan p không tham gia vào quá trình lai hóa tạo thành liên kết ba điện tử ở tâm với hai ôxy ở đầu tận cùng.
Hydroxy hydro trong axit nitric tạo thành các liên kết hydro nội phân tử với các nguyên tử oxy không hydroxyl hóa. Đây là lý do chính tại sao axit nitric có tính axit yếu hơn axit sulfuric và axit clohiđric và có nhiệt độ sôi thấp hơn hai loại trước đây.
Axit nitric đậm đặc không ổn định và bị phân hủy giải phóng nitơ đioxit khi tiếp xúc với ánh sáng hoặc nhiệt. Khí nitơ đioxit sinh ra khi phân hủy hòa tan trong axit nitric, tạo ra màu vàng nhạt. Nhưng axit nitric loãng tương đối ổn định.
Phương trình phản ứng:
4HNO3 —-> 4NO2 + O2 + H2O
Nói chung, người ta tin rằng axit nitric có thể bị ion hóa hoàn toàn trong dung dịch nước, tạo ra một lượng lớn các ion hydro.
Axit nitric trong tự nhiên chủ yếu được hình thành do oxit nitric sinh ra trong mưa giông hoặc nitơ đioxit do hoạt động sống của vi sinh vật thải ra. Các hoạt động của con người cũng tạo ra các oxit nitơ.
Các nguồn ô nhiễm nhân tạo trên thế giới thải ra khoảng 53 triệu tấn nitơ oxit mỗi năm và các oxit nitơ này cũng tạo thành axit nitric.
Axit nitric không ổn định về bản chất và không thể tồn tại lâu dài trong tự nhiên, nhưng sự hình thành axit nitric là một phần của chu trình nitơ.
Sự tạo thành oxit nitric: N2 + O2 → 2NO
Sự tạo thành nitơ đioxit: 2NO + O2 = 2NO2
Nitơ đioxit sinh ra được hòa tan vào nước tạo ra axit nitric: 3NO2 + H2O = 2HNO3 + NO
Các phương trình hóa học:
P + 5HNO3 = H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO