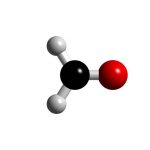
Hydrogen sulfide là tên tiếng anh của hydro sunfua, là một hợp chất vô cơ có công thức hóa học là H2S. Bình thường nó là một khí axit không màu và dễ cháy, và nó cũng là một hiđrua của các nguyên tố nhóm oxy.
Hydro sunfua là một chất cấp tính và có độc tính cao, có mùi trứng thối. Hít phải một lượng nhỏ hydro sunfua nồng độ cao có thể gây tử vong chỉ trong thời gian ngắn. Hydro sunfua ở nồng độ thấp có ảnh hưởng đến mắt, hệ hô hấp và hệ thần kinh trung ương. Nó là chất độc, ăn mòn và có thể bị đốt cháy.
Hydro sunfua thường được tạo ra do sự phân hủy chất hữu cơ trong điều kiện không có oxy ở sinh vật nhân sơ, chẳng hạn như trong đầm lầy và cống rãnh; quá trình này thường được gọi là phân hủy kỵ khí và quá trình này được thực hiện bởi các vi sinh vật khử sunfat.
Hydro sunfua cũng có trong một số nguồn khí núi lửa, khí tự nhiên và nước giếng. Cơ thể con người tạo ra một lượng nhỏ H2S, được sử dụng để truyền tín hiệu tế bào.
Hydro sunfua tồn tại tự nhiên trong dầu thô, khí đốt tự nhiên, khí núi lửa và suối nước nóng. Một lượng nhỏ hydro sunfua có trong dầu thô, nhưng khí tự nhiên có thể chứa tới 90% hydro sunfua; nó cũng có thể được tạo ra bởi vi khuẩn trong quá trình phân hủy chất hữu cơ trong điều kiện thiếu khí, hoặc phổ biến ở một phần hư hỏng rong biển. Xì hơi do cơ thể con người thải ra có chứa một lượng rất nhỏ (dưới 1% thành phần xì hơi) hydro sunfua.
Hydro sunfua thường được sản xuất bằng cách tách khí axit, tức là khí tự nhiên với một lượng lớn H2S. Nó cũng có thể được hình thành bằng cách kết hợp hydro và lưu huỳnh lỏng ở 450 ° C. Hydrocacbon có thể được sử dụng như một nguồn hydro trong phản ứng.
Để sản xuất hiđro sunfua có một phương pháp đơn giản đó là thủy phân nhôm sunfua (màu trắng). Phương pháp này sử dụng quá trình thủy phân sunfua của các kim loại hoạt động (trừ kim loại kiềm). Nhôm selenua (xám) và nhôm Telluride (xám đen) cũng có thể phản ứng nhanh với nước để tạo ra hydro selenua và telluride hydro. Hầu hết các sunfua kim loại và phi kim loại, chẳng hạn như nhôm sunfua, photpho pentasunfua, và silic đisunfua sẽ tạo thành sunfua hydro khi tiếp xúc với nước.
Hydro sunfua không ổn định hơn nước cùng họ và bị phân hủy khi đun nóng trên 700K. Hydro sunfua và lưu huỳnh đioxit phản ứng nhanh chóng ngay cả ở trạng thái lỏng.
Hydro sunfua hơi nặng hơn không khí, và hỗn hợp hydro sunfua và không khí cực kỳ dễ nổ. Quá trình đốt cháy hydro sunfua và oxy tạo ra ngọn lửa màu xanh lam, tạo thành lưu huỳnh đioxit và nước. Trong các phản ứng hóa học nói chung, hiđro sunfua là chất khử, ví dụ, hiđro sunfua có thể phản ứng với lưu huỳnh đioxit để tạo thành nguyên tố lưu huỳnh và nước.
Hydro sunfua ít tan trong nước và tạo thành một axit yếu được gọi là “axit hydrosulfuric”. Dung dịch nước của nó chứa hydro sunfat HS- (trong dung dịch ở 18 độ C và nồng độ 0,01-0,1 mol / lít, pKa = 6,9) và ion sunfat S2- (pKa = 11,96). Lúc đầu, axit hydrosulfuric trong sẽ trở nên đục sau khi để một thời gian, là do axit hydrosulfuric sẽ phản ứng từ từ với oxy hòa tan trong nước tạo ra lưu huỳnh nguyên tố không hòa tan trong nước.
Phương trình hóa học:
Cl2 + H2S → 2HCl + S
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl