Natri aluminat, còn được gọi là natri metaaluminat, là một hợp chất vô cơ và là một sản phẩm hóa học quan trọng. Nó là một nguyên liệu thô hiệu quả để sản xuất nhôm hydroxit, được sử dụng rộng rãi trong công nghiệp và công nghệ.
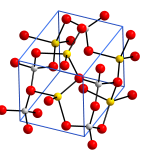
Natri aluminat tinh khiết (khan) là một tinh thể màu trắng, có thể được biểu diễn bằng nhiều công thức phân tử khác nhau, chẳng hạn như NaAlO2, Na2O · Al2O3 hoặc Na2Al2O4 hoặc Na [Al (OH) 4].
Natri aluminat thu được bằng cách hòa tan nhôm hydroxit trong dung dịch xút. Nhôm hydroxit (bauxit nước) có thể được hòa tan trong dung dịch xút có chứa 20-25% nước ở nhiệt độ gần với nhiệt độ sôi.
Việc sử dụng dung dịch xút có nồng độ cao hơn có thể tạo ra sản phẩm bán rắn. Quá trình phản ứng phải thực hiện trong bình chứa niken hoặc thép được nung bằng hơi nước, đồng thời nhôm hiđroxit và xút 50% nên đun sôi cùng nhau cho đến khi tạo ra chất giống như bột giấy, người ta đổ hỗn hợp này vào bồn chứa và làm lạnh, để tạo thành chất rắn chứa 70% NaAlO2.
Sau khi nghiền, nó được khử nước trong lò quay đã được làm nóng và đun nóng trực tiếp hoặc gián tiếp với hydro đốt cháy, sản phẩm cuối cùng chứa 90% NaAlO2, 1% nước và 1% xút tự do.
Natri clorua (công thức hóa học: NaCl) là một hợp chất ion. Nguyên tử khối của ion natri và ion clorua lần lượt là 22,99 và 35,45 g/mol. Điều này có nghĩa là 100 g natri clorua chứa 39,34 g natri và 60,66 g clo.
Natri clorua là thành phần chính của muối trong nước biển, và sự tồn tại của nó cũng làm cho nước biển có vị mặn riêng. Natri clorua cũng là muối chính của dịch ngoại bào, dung dịch nước natri clorua 0,89% thường được gọi là nước muối thường. Dạng ăn được của nó là thành phần chính của muối ăn, được dùng chủ yếu để làm gia vị và bảo quản thực phẩm.
Natri clorua là một nguyên liệu thô không thể thiếu trong quá trình sản xuất các phản ứng hóa học khác nhau, và nó hầu như không thể thiếu cho dù nó được sử dụng trực tiếp hay gián tiếp.
Điều chế natri kim loại:
2Na + Cl2 → 2NaCl
Điện phân nước muối bão hòa:
2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
Phản ứng với bạc nitrat:
AgNO3 + NaCl = AgCl + NaNO3
Axit sunfuric đậm đặc được thêm vào natri clorua rắn:
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
Dung dịch HCl phản ứng với dung dịch muối NaAlO2 tạo kết tủa keo trắng:
3HCl + Al(OH)3 → AlCl3 + 3H2O
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl
Nhôm hiđroxit phản ứng với dung dịch axit HCl tạo muối nhôm clorua và nước:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Cách thử nghiệm NaCl:
– Một: Nhỏ từng giọt dung dịch bạc nitrat đã được axit nitric hóa vào dung dịch natri clorua, thấy có kết tủa trắng (kết tủa bạc clorua), chứng tỏ có Cl-.
– Hai: Nhúng một lượng nhỏ dung dịch bằng dây bạch kim, đưa lên đèn cồn đốt cháy, ngọn lửa có màu vàng, chứng tỏ có Na +.
– Ba: Để loại bỏ nhiễu, thêm bari hydroxit bão hòa vào dung dịch thử ban đầu cho đến khi nó rõ ràng là kiềm. Lúc này, hầu hết các cation, PO43− và các anion khác sẽ bị kết tủa.
Ba2 + được đưa vào dung dịch thử phải được loại bỏ bằng amoni cacbonat, và cuối cùng là loại bỏ muối amoni bằng cách đốt cháy.
Sau khi đun nóng cặn và rửa trôi bằng nước, dung dịch được axit hoá bằng HAc, người ta thêm thuốc thử uranyl kẽm axetat theo số giọt 1: 8 và dùng đũa thuỷ tinh cọ vào thành ống nghiệm. kết tủa tinh thể màu vàng được tạo thành, nó cho thấy sự có mặt của Na +.