Nitơ là dạng nguyên tố của nitơ, và công thức hóa học của nó là N2. Nitơ là khí có tỷ trọng cao nhất trong bầu khí quyển của trái đất, chiếm 78,3% (tiếp theo là 20,99% oxy).
Nói chung, nitơ không dễ bắt lửa cũng không hỗ trợ quá trình đốt cháy, nhưng đối với magiê, nó có thể hỗ trợ quá trình đốt cháy.
3Mg + N2 ⟶ Mg3N2
Chưng cất phân đoạn không khí lỏng N2, điểm sôi thấp hơn O2. Đầu tiên được hóa hơi nhưng không thể lấy được N2 tinh khiết.
Nitơ cũng có thể thu được bằng cách xử lý không khí ở dạng khí bằng các phương pháp cơ học (chẳng hạn như màng thẩm thấu ngược có áp suất và phương pháp hấp phụ xoay áp).
Nitơ thương mại thường là sản phẩm phụ của oxy công nghiệp. Nitơ công nghiệp sau khi được nén lại được đóng trong các bình thép đen, thường được gọi là OFN (nitơ không chứa oxy).
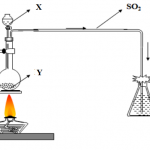
Phương pháp thực nghiệm:
Cho hỗn hợp amoni clorua với natri nitrit đun nóng:
NH4CL + NaNO3 = NaCL + N2O + 2H2O
Phản ứng này cũng tạo ra một lượng nhỏ NO và HNO 3, sản phẩm khí có thể được loại bỏ bằng cách cho axit sunfuric lỏng có trộn với kali đicromat.
Không khí tinh khiết khử oxy qua bột đồng nóng hoặc lưới thép đồng:
N2 + O2→ 2NO
N2 + 2O2 → 2NO2
4N2 + O2 + 2Cu = 4N2 + 2 CuO
Amoniac đi qua đồng oxit nóng:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Nitơ có độ tinh khiết cao có thể thu được bằng phản ứng phân hủy nhiệt của bari azit hoặc natri azit:
2NaN3 (s) → 2Na (s) + 3N2 (g)
Khí bảo vệ không đắt tiền và ổn định, được sử dụng cho môi trường bảo vệ đơn giản trong quá trình luyện kim loại và tổng hợp ở nhiệt độ cao (nhưng độ ổn định của nó không tốt như heli và argon); được sử dụng để tổng hợp nitrua ở nhiệt độ cao (như gốm sứ silicon nitride, nitride Boron,vv).
Các hợp chất của nó cũng được sử dụng trong nông nghiệp, chẳng hạn như phân bón nitơ. Nitơ lỏng đôi khi được sử dụng để làm mát.
Ngoài ra, nitơ là khí nạp cho thực phẩm đóng gói, được sử dụng để duy trì hình dạng của gói để tránh bị hư hỏng khi bóp, và quan trọng hơn là cách ly oxy và ngăn thực phẩm bị hư hỏng.
Nitơ đóng vai trò quan trọng trong việc bảo vệ sự sống, nitơ bền vững về mặt hóa học, không giống như các loại khí khác hoạt động quá mạnh và dễ phá hủy cấu trúc sinh học, nó còn có vai trò ngăn chặn tác động của các hạt không gian và thiên thạch trong bầu khí quyển.
Trọng lượng của N2 tương tự như oxy, nhẹ hơn oxy và sẽ không làm cho oxy bị thải ra ngoài không khí quá cao hoặc tập trung quá nhiều trên bề mặt trái đất.
Hơn nữa, hiệu ứng nhà kính của nó không rõ ràng, và nó sẽ không làm cho nhiệt độ bề mặt trái đất quá cao. Vì vậy, một môi trường ổn định thích hợp cho sự phát triển và tiến hóa được cung cấp cho sinh vật.
Nitơ có thể được sử dụng để phản ứng với hydro với sự có mặt của chất xúc tác là sắt để tạo ra amoniac. Đây được gọi là phương pháp Haber.
2N2 + 3H2 <=> 2NH3 (deltaH < O)
Amoniac có thể được sử dụng trong quá trình tổng hợp phân bón và các hợp chất khác.