Hydrogen sulfide hay còn gọi là hydro sunfua là một hợp chất vô cơ có công thức hóa học H₂S. Nó là một nguyên liệu hóa học quan trọng, thường là khí axit không màu, dễ cháy, khi trộn với không khí có thể tạo thành hỗn hợp nổ, có thể gây cháy và nổ trong trường hợp cháy nổ và năng lượng nhiệt cao.
Hydro sunfua là một chất cấp tính và có độc tính cao, có mùi trứng thối. Hydro sunfua nồng độ thấp có ảnh hưởng đến mắt, hệ hô hấp và hệ thần kinh trung ương. Hít phải một lượng nhỏ hydro sulfua nồng độ cao có thể gây tử vong trong thời gian ngắn thời gian.
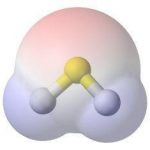
Cấu tạo phân tử: Nguyên tử trung tâm S thông qua kiểu lai hóa sp³ (kết quả thực tế tính theo góc liên kết gần với kiểu lai hóa p³), cấu hình cặp electron là tứ diện đều, cấu hình phân tử là hình V, và H-S-H góc liên kết là 92,1 °, mômen lưỡng cực là 0,97 D, và nó là một phân tử phân cực. Do năng lượng liên kết H-S yếu, hydro sunfua bị phân hủy ở khoảng 300 ° C.
Điểm bốc cháy: 260 ° C, áp suất hơi bão hòa: 2026,5kPa / 25,5 ° C, độ hòa tan: hòa tan trong nước (tỷ lệ hòa tan 1: 2,6), etanol, cacbon disunfua, glycerin, xăng, dầu hỏa, v.v. Nhiệt độ tới hạn: 100,4 ° C, áp suất tới hạn: 9,01MPa.
Hydro sunfua là một chất khí không màu, có độc tính cao, có tính axit. Có mùi đặc biệt của trứng thối, ngưỡng khứu giác: 0,00041ppm, thậm chí nồng độ hydrogen sulfide thấp sẽ gây hại cho khứu giác của con người. Ở nồng độ cao, không có mùi (vì nồng độ hydro sunfua cao có thể làm tê liệt dây thần kinh khứu giác). Sử dụng mũi như một phương tiện để phát hiện khí này có thể gây chết người.
Hydro sunfua khô hoàn toàn không phản ứng với oxy trong không khí ở nhiệt độ phòng, nhưng nó có thể cháy trong không khí khi bắt lửa, và cháy trong quá trình khoan và hoạt động ở hố ga, với tỷ lệ cháy chỉ khoảng 86%. Hydro sunfua cháy với ngọn lửa xanh và tạo ra khí sulfur dioxide độc hại, có thể gây hại cho mắt và phổi của con người. Khi có đủ không khí tạo ra SO2 và H2O. Nếu thiếu không khí hoặc nhiệt độ thấp sẽ tạo ra S và H2O tự do.
Ngoài oxy hoặc không khí, hydro sunfua cũng có thể cháy trong clo và flo.
Tính tan: Khí hydro sunfua hòa tan trong nước, etanol và glixerol, tính chất hóa học của nó không ổn định. Nó ít hòa tan trong nước và tạo thành một axit yếu được gọi là “axit hydrosulfuric”. Dung dịch nước của nó chứa bisulfat HS- (ở 18 ° C, với nồng độ 0,01-0,1 M / L, pKa = 6,9) và các ion sulfua S2- (pKa còn gây tranh cãi, từ 12 đến 17). Axit hydrosulfuric trong suốt ban đầu sẽ bị vẩn đục sau một thời gian, vì axit hydrosulfuric sẽ phản ứng chậm với oxy hòa tan trong nước tạo ra lưu huỳnh nguyên tố không hòa tan trong nước.
Hydro sunfua là một axit yếu đi bazơ. Ở 20 ° C, 1 thể tích nước có thể hòa tan 2,6 thể tích hydro sunfua, và dung dịch nước tạo thành được gọi là axit hydrosulfuric với nồng độ 0,1 mol / L. Mức độ ion hóa giai đoạn hai của hydro sunfua trong nước thấp đến mức chỉ có thể phát hiện ion lưu huỳnh bằng thiết bị khi nồng độ hydroxit đạt ít nhất 8mol / L.
Một số phản ứng hóa học:
H2 + S → H2S
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
> Cân bằng phản ứng Zn + H2SO4 = ZnSO4 + H2O + H2S (và phương trình Zn + H2SO4 = ZnSO4 + SO2 + H2O)
> Cân bằng phản ứng Cl2 + H2O + SO2 = H2SO4 + HCl (và phương trình H2S + Cl2 + H2O = H2SO4 + HCl)
> Cân bằng phản ứng Na + S = Na2S (và phương trình Na2S + PbSO4 = Na2SO4 + PbS)
> Cân bằng phản ứng Cl2 + KBr = Br2 + KCl (và phương trình Cl2 + NaI = I2 + NaCl )
> Cân bằng phản ứng Cl2 + Fe = FeCl3 (và phương trình Cl2 + Ca(OH)2 = Ca(OCl)2 + CaCl2 + H2O)