Natri clorua là một hợp chất ion vô cơ, công thức hóa học NaCl, tinh thể lập phương không màu hoặc bột kết tinh mịn, có vị mặn.
Bề ngoài là các tinh thể màu trắng, và nguồn gốc của nó chủ yếu là nước biển, thành phần chính của muối ăn. Dễ tan trong nước và glycerin, ít tan trong etanol (rượu), amoniac lỏng; không tan trong axit clohydric đậm đặc.
Natri clorua không tinh khiết sẽ bốc hơi trong không khí. Độ ổn định tương đối tốt, và dung dịch nước của nó là trung tính.
Trong công nghiệp, phương pháp điện phân dung dịch bão hòa natri clorua thường được sử dụng để sản xuất hydro, clo, xút (natri hydroxit) và các sản phẩm hóa học khác (nói chung được gọi là công nghiệp clor-kiềm).
Natri clorua có thể được sử dụng để nấu chảy quặng (điện phân các tinh thể natri clorua nóng chảy để tạo ra kim loại natri hoạt động), để điều chế nước muối sinh lý trong điều trị y tế và làm gia vị trong cuộc sống hàng ngày.
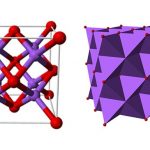
Các tinh thể của natri clorua tạo thành đối xứng lập thể. Trong cấu trúc tinh thể của nó, các ion clorua lớn hơn được sắp xếp để tạo thành hình vuông dày đặc nhất và các ion natri nhỏ hơn lấp đầy các khoảng trống hình bát diện giữa các ion clorua.
Mỗi ion được bao quanh bởi sáu ion khác. Cấu trúc này cũng tồn tại trong nhiều hợp chất khác, được gọi là cấu trúc loại natri clorua hoặc cấu trúc muối mỏ.
1. Điện phân natri clorua nóng chảy để tạo ra natri kim loại
2NaCl → 2Na + Cl2
2. Điện phân nước muối
2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
3. Phản ứng với bạc nitrat
AgNO3 + NaCl → AgCl + NaNO3
4. Phản ứng với axit sunfuric đặc (sản xuất hydro clorua trong phòng thí nghiệm)
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
5. Kiểm tra NaCl
- Nhỏ dung dịch bạc nitrat đã được axit nitric hóa vào dung dịch natri clorua, thấy có kết tủa trắng (kết tủa bạc clorua), chứng tỏ có Cl-.
- Nhúng một lượng nhỏ dung dịch bằng dây bạch kim, cho vào đèn cồn đốt cháy, ngọn lửa có màu vàng, chứng tỏ có Na +.
- Để loại bỏ nhiễu, thêm bari hydroxit bão hòa vào dung dịch thử ban đầu cho đến khi nó rõ ràng là kiềm. Lúc này, hầu hết các cation, PO43− và các anion khác sẽ bị kết tủa. Ba2 + được đưa vào dung dịch thử phải được loại bỏ bằng amoni cacbonat, và cuối cùng là loại bỏ muối amoni bằng cách đốt cháy. Sau khi đun nóng cặn và rửa trôi bằng nước, dung dịch được axit hoá bằng HAc, người ta thêm thuốc thử uranyl kẽm axetat theo số giọt 1: 8 và dùng đũa thuỷ tinh cọ vào thành ống nghiệm. kết tủa tinh thể màu vàng được tạo thành, nó cho thấy sự có mặt của Na +.
Hòa tan muối thô vào nước để loại bỏ các tạp chất không tan, sau đó thêm các chế phẩm tinh chế như natri hydroxit và natri cacbonat để làm kết tủa các tạp chất hòa tan, lọc và loại bỏ, cuối cùng điều chỉnh pH đến 7 bằng axit clohydric tinh khiết, cô đặc dung dịch thu được tinh thể natri clorua tinh khiết.
Phương pháp chuẩn bị trong phòng thí nghiệm là trộn một lượng bằng nhau của axit clohydric và natri hiđroxit để tạo ra dung dịch natri clorua. Chưng cất dung dịch thu được tinh thể natri clorua. Phản ứng chính:
NaOH + HCl → NaCl + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Ngoài ra, natri clorua cũng sẽ được tạo ra khi natri kim loại được đốt cháy trong môi trường clo. Phương trình hóa học của nó là:
2Na + Cl2 → 2NaCl