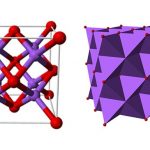
Ferrous sulfide (công thức hóa học: FeS) là một sulfua của sắt (II), là một tinh thể lục giác màu nâu sẫm, không hòa tan trong nước ở trạng thái tiêu chuẩn và có đặc tính không phân biệt. Nó dễ bị ôxy hóa bởi không khí để tạo ra các ôxít sắt có giá thành cao (như tetroxit sắt) và lưu huỳnh. Sulfua sắt dạng bột sẽ tự bốc cháy.
Sulfua sắt có thể được tạo ra bởi phản ứng kín ở nhiệt độ cao của nguyên tố sắt và lưu huỳnh, hoặc do tác dụng của muối sắt (II) và sunfua kim loại kiềm trong dung dịch nước.
S8 + 8 Fe → 8 FeS
Fe2 + + S2− → FeS ↓
Sulfua sắt trong tự nhiên tồn tại ở dạng pyrotin. Nó có sẵn ở cả dạng đơn tà và dạng lục phương, cả hai đều là hợp chất không phân cực thiếu nguyên tử sắt và có công thức hóa học khoảng Fe7S8.
Sulfua sắt là phản sắt từ, không hòa tan trong nước, nhưng hòa tan trong axit clohydric để giải phóng khí hydro sunfua, và thường được sử dụng làm chất tạo hydro sunfua trong phòng thí nghiệm.
FeS + 2 HCl → FeCl2 + H2S ↑
Sulfua sắt bắt đầu bị phân hủy khi đun nóng trong chân không đến 1100 ° C.
Các hợp chất sunfua sắt khác bao gồm:
- Sắt sunfua, Fe2S3, không bền và bị phân hủy khi đun nóng.
- Sắt disulfua, FeS2, có hai cấu trúc, pyrit và marcasit, và bị phân hủy khi đun nóng đến 600 ° C.
- Fe7S8, cấu trúc kiểu pyrotin.
- Lưu huỳnh sắt cụm.
Lưu huỳnh chủ yếu đến từ nguyên liệu thô, và lưu huỳnh là nguyên tố có hại cho hầu hết các loại thép. Vì vậy khử lưu huỳnh là một trong những nguyên công cơ bản của quá trình luyện thép.
Lưu huỳnh có trong thép dưới dạng FeS. Lưu huỳnh gây ra hiện tượng “nóng chảy” của thép. Điểm nóng chảy của FeS là 1193 ℃, trong khi eutectic bao gồm Fe và FeS có điểm nóng chảy chỉ 985 ℃. Fe lỏng và FeS tan vô hạn trong nhau, nhưng độ tan của FeS trong sắt rắn rất nhỏ, chỉ từ 0,015% đến 0,020%.
Do đó, khi hàm lượng lưu huỳnh của thép vượt quá 0,020%, do sự phân tách của thép nóng chảy trong quá trình làm nguội và đông đặc, Fe-FeS được phân bố ở ranh giới hạt như một eutectic với điểm nóng chảy thấp; nhiệt độ làm việc nóng của thép là 1150-1200 ° C.
Ở nhiệt độ này, eutectic ở ranh giới thớ đã nóng chảy, và khi ép thép, ranh giới thớ bị phá vỡ, đó là “tính giòn nóng” của thép. Khi hàm lượng oxy trong thép cao, nhiệt độ nóng chảy của eutectic tạo thành bởi FeO và FeS thấp hơn, chỉ còn 940 ℃, điều này làm trầm trọng thêm hiện tượng “giòn nóng” của thép.
Ngoài ra, lưu huỳnh sẽ làm giảm đáng kể tính năng hàn của thép, gây nứt ở nhiệt độ cao, sinh ra nhiều rỗ và độ xốp trong kim loại mối hàn, do đó làm giảm độ bền của mối hàn. Khi hàm lượng lưu huỳnh vượt quá 0,06%, khả năng chống ăn mòn của thép bị suy giảm đáng kể.
Đối với sắt và thép silic trong công nghiệp, tổn thất từ trễ tăng lên khi hàm lượng S trong thép tăng lên, ảnh hưởng đến tính chất điện từ của thép. Đồng thời, sự phân tách lưu huỳnh trong cấu trúc đông đặc của tấm (hoặc thỏi) đúc liên tục cũng là nghiêm trọng nhất.
Một số phương trình hóa học:
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
FeS + 12HNO3 → 9NO2 + Fe(NO3)3 + 5H2O + H2SO4