Sắt sunfua (công thức hóa học: Fe2S3) là một trong những sunfua sắt, ngoài ra còn có FeS và FeS2. Nó là một chất bột rắn màu nâu, nhưng nó bị phân hủy thành bột màu vàng xanh ở nhiệt độ phòng. Đây là một sản phẩm nhân tạo rất không ổn định, không tồn tại trong tự nhiên.
Fe2S3 được điều chế bằng cách pha loãng FeCl3 đông lạnh thành Na2S đã nguội.
2 FeCl3 + 3 Na2S → Fe2S3 ↓ + 6 NaCl
Nó phân hủy thành sunfua đen và lưu huỳnh khi nhiệt độ vượt quá 20 ° C.
Fe2S3 → 2 FeS + S ↓
Phương trình phản ứng với axit clohydric như sau:
Fe2S3 + 4 HCl → 2 FeCl2 + 2 H2S ↑ + S ↓
Ferrous sulfide (công thức hóa học: FeS) là một sulfua của sắt (II), ở trạng thái tiêu chuẩn, nó là một tinh thể hình lục giác màu nâu đen, khó hòa tan trong nước và có tính chất phi metric. Nó dễ dàng bị oxy hóa bởi không khí để tạo ra các oxit sắt có giá cao (như oxit sắt) và lưu huỳnh. Sulfua sắt dạng bột sẽ tự bốc cháy.
Phản ứng nhiệt độ cao kín khí của nguyên tố sắt và lưu huỳnh, hoặc tác dụng của muối sắt (II) và sunfua kim loại kiềm trong dung dịch nước sẽ tạo ra sunfua sắt.
S8 + 8 Fe → 8 FeS
Fe2 + + S2− → FeS ↓
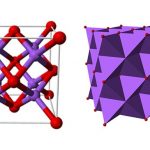
Sắt sunfua trong tự nhiên tồn tại ở dạng pyrotin. Nó có hai loại là đơn chất và lục bội, đều là hợp chất không định lượng, thiếu nguyên tử sắt, công thức hóa học xấp xỉ là Fe7S8.
Ferrous sulfide là phản sắt từ và hầu như không hòa tan trong nước, nhưng nó hòa tan trong axit clohydric và phát ra khí hydro sunfua. Nó thường được sử dụng làm máy tạo hydro sunfua trong phòng thí nghiệm.
FeS + 2 HCl → FeCl2 + H2S ↑
Khi đun nóng trong chân không đến 1100 ° C, sắt sulfua bắt đầu bị phân hủy.
Sắt disulfide là một hợp chất vô cơ có công thức hóa học là FeS2, thường được gọi là ferrous disulfide. Chủ yếu có hai loại khoáng chất trong tự nhiên: pyrit và marcasit.
Nguyên liệu Fe có hoá trị +2, S hoá trị -1, đặc biệt hơn cả nguyên tử nhóm S2 đều có hoá trị -2. Là thành phần chính của pyrit, FeS2 có tính khử từ, là chất không hoạt động ở nhiệt độ phòng và trở nên hoạt động khi nhiệt độ tăng. Nó bị oxy hóa thành oxit sắt và oxit lưu huỳnh trong không khí, và chủ yếu được sử dụng trong sản xuất lưu huỳnh đioxit, axit sulfuric và pin lithium.
Trong tự nhiên, FeS2 chủ yếu tồn tại ở dạng marcasit và pyrit, pyrit là khoáng vật sunfua phân bố rộng rãi nhất và có thể xuất hiện trong mọi loại đá. Pyrit là nguyên liệu chính để chiết xuất lưu huỳnh và tạo ra axit sunfuric, đồng thời nó cũng là một loại đá quý cổ rất rẻ.
ói chung, đối với pyrit tự nhiên, lượng lưu huỳnh sai lệch so với thành phần lý tưởng (phần trăm khối lượng) là dưới 1,3%, tương ứng với FeS2-x (x≤0,07). Khi có nước, các phản ứng oxi hóa sau dễ xảy ra:
2FeS2 + O2 + 2H2O → 2FeSO4 + 2H2SO4
Trong số đó có thiosunfat, sulfit và lưu huỳnh. Vì thể tích mol của pyrit nhỏ hơn của lưu huỳnh nên lưu huỳnh sinh ra trong quá trình ôxy hóa sẽ không gây ra hiện tượng giãn nở bề mặt và các ôxít bề mặt được tạo ra có thể ngăn chặn quá trình ôxy hóa tiếp tục một cách hiệu quả.
Phương trình hóa học liên quan:
FeS + 6HNO3 ⟶ 2H2O + H2SO4 + 3NO + Fe(NO3)3
3FeS + 2H3PO4 → 3H2S + Fe3O8P2