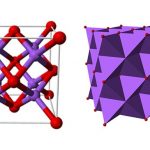
Bari oxit (BaO) là một hợp chất hút ẩm màu trắng, không cháy. Nó có cấu trúc hình khối và được sử dụng trong ống tia âm cực, thủy tinh vương miện và chất xúc tác. Nó có hại cho da người và nếu nuốt phải một lượng lớn sẽ gây kích ứng. Lượng bari oxit quá mức có thể dẫn đến tử vong.
Bari oxit là một tinh thể lập phương không màu. Hòa tan trong axit, không hòa tan trong axeton và amoniac. Nó phản ứng với nước hoặc hơi nước để tạo ra một phản ứng tỏa nhiệt mạnh mẽ để tạo ra bari hydroxit, chất này có thể dễ dàng hấp thụ độ ẩm và carbon dioxide trong không khí để tạo ra bari cacbonat.
Bari oxit được điều chế bằng cách đun nóng bari cacbonat với than cốc, muội than hoặc hắc ín hoặc bằng cách phân hủy nhiệt bari nitrat.
Bari oxit được dùng làm lớp phủ cho các catốt nóng, ví dụ như trong các ống tia catốt. Nó đã thay thế chì (II) oxit trong sản xuất một số loại thủy tinh như thủy tinh quang học. Trong khi ôxít chì làm tăng chiết suất, nó cũng làm tăng công suất phân tán, mà ôxít bari không thay đổi.
Bari oxit cũng được sử dụng như một chất xúc tác etoxyl hóa trong phản ứng của etylen oxit và rượu, diễn ra trong khoảng từ 150 đến 200 ° C.
Nó cũng là một nguồn oxy tinh khiết thông qua sự dao động nhiệt. Nó dễ dàng oxy hóa thành BaO2 bằng cách hình thành ion peroxit. Quá trình peroxy hóa hoàn toàn BaO thành BaO2 xảy ra ở nhiệt độ vừa phải nhưng entropi của phân tử O2 tăng lên ở nhiệt độ cao có nghĩa là BaO2 bị phân hủy thành O2 và BaO ở 1175K.
Phản ứng được sử dụng như một phương pháp quy mô lớn để sản xuất oxy trước khi tách khí trở thành phương pháp thống trị vào đầu thế kỷ 20. Phương pháp này được đặt tên là quá trình Brin, theo tên những người phát minh ra nó.
Bari oxit là một chất gây kích ứng. Nếu nó tiếp xúc với da hoặc mắt hoặc hít phải, nó sẽ gây đau và đỏ. Tuy nhiên, nó nguy hiểm hơn khi ăn vào. Nó có thể gây buồn nôn và tiêu chảy, tê liệt cơ, rối loạn nhịp tim và có thể gây tử vong. Nếu nuốt phải, cần được chăm sóc y tế ngay lập tức.
Bari oxit được tạo ra bằng cách đun nóng bari cacbonat. Nó cũng có thể được điều chế bằng cách phân hủy nhiệt bari nitrat. Tương tự như vậy, nó thường được hình thành thông qua sự phân hủy của các muối bari khác.
2Ba + O2 → 2BaO
BaCO3 → BaO + CO2
Phương pháp nung: Nung bari nitrat có độ tinh khiết cao đã được nghiền mịn ở 1000 ~ 1050 ℃ để thu được bari oxit. Phương trình phản ứng là:
2Ba (NO3) 2 → 2BaO + 4NO ↑ + 3O2 ↑
Hoặc trộn bari cacbonat với than cốc và phản ứng ở 1200 ° C để thu được oxit bari thành phẩm. Phương trình phản ứng là:
BaCO3 + C → BaO + 2CO
Bari oxit nguyên chất có thể bị phân hủy bằng nhiệt với bari cacbonat nguyên chất trong điều kiện chân không cao. Đèn giải phóng hầu hết CO2 ở 950 ° C, sau đó đốt nóng đến 1100 ~ 1150 ° C để giải phóng tất cả CO2. Phương pháp này có thể ngăn không cho sản phẩm phản ứng bị nóng chảy.
tinh khiết cũng có thể được điều chế bằng cách khử nước cẩn thận Ba (OH) 2 · 8H2O được tinh chế bằng cách kết tinh lại nhiều lần, và cuối cùng nung nó ở 800 ° C trong 2 giờ trong dòng khí N2 hoặc H2 khô không có O2 và CO2.
Các phương trình hóa học liên quan:
BaO + CO2 → BaCO3↓
CO2+ Ba(OH)2 → BaCO3↓+ H2O