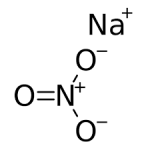
Natri nitrat là một loại muối vô cơ, công thức hóa học là NaNO3. Natri nitrat được đun nóng đến 380 ° C và phân hủy để tạo ra natri nitrit và oxy:
2NaNO3 → 2NaNO2 + O2
Đồng (II) nitrat hoặc đồng nitrat, có công thức hóa học là Cu (NO3) 2, là một muối vô cơ có màu xanh lam bóng hấp dẫn. Nó được tổng hợp thông qua sự phân hủy các khoáng chất đồng, bao gồm các khoáng chất đồng, quặng sắt xanh và vitriol sắt.
Về nguyên liệu và lượng muối cần thiết, các phương pháp khác khả thi hơn bao gồm phản ứng trực tiếp với đồng kim loại và các dẫn xuất của nó. Khi cho đồng và axit nitric đặc (HNO3) thì xảy ra phản ứng oxi hóa – khử.
Trong phản ứng này, theo phương trình hoá học sau, đồng bị oxi hoá và nitơ bị khử: đồng + 4HNO3 (đặc) => đồng (không 3) 2 (ac) + 2 giờ 2O (l) + 2
Nitrogen dioxide (NO2) là một chất khí màu nâu có hại, dung dịch nước tạo thành có màu xanh lam. Đồng sẽ tạo thành các ion cốc (Cu +), ion đồng (Cu2 +) hoặc các ion ít phổ biến hơn Cu3 +; tuy nhiên, do nhiều yếu tố điện tử, năng lượng cao và hình học, các ion cốc không phổ biến trong môi trường nước.
Thế khử tiêu chuẩn của đồng + (0,52V) lớn hơn của đồng 2+ (0,34V), có nghĩa là đồng + không bền hơn và có xu hướng thu nhận điện tử và trở thành Cu (s). Phép đo điện hóa này giải thích tại sao không có CuNO3 là sản phẩm phản ứng, hoặc ít nhất là trong nước.
Đồng nitrat ở dạng khan (khô) hoặc ngậm nước với các tỷ lệ nước khác nhau. Anhydrit axit là chất lỏng màu xanh lam, nhưng sau khi phối hợp với phân tử nước (có thể tạo liên kết hiđro) nó sẽ kết tinh thành đồng (NO3) hoặc Cu.
Đây là ba chất thường được sử dụng trên thị trường dạng muối. Khối lượng phân tử của muối khô là 187,6 g / mol và tổng khối lượng phân tử của mỗi phân tử nước thêm vào muối là 18 g / mol. Mật độ của nó bằng 3,05 g / mL, và đối với mỗi phân tử nước được kết hợp, mật độ sẽ giảm: 2,32 g / mL đối với muối trihydrat và 2,07 g / mL đối với muối hexahydrat. Nó không có điểm sôi, nhưng thăng hoa.
Cả ba dạng nitrat đồng đều hòa tan nhiều trong nước, amoniac, dioxan và etanol. Khi một phân tử khác được thêm vào các quả cầu phối trí bên ngoài của đồng, điểm nóng chảy của chúng giảm xuống. Sau khi nóng chảy, đồng nitrat bị nhiệt phân hủy và tạo ra khí NO có hại 2:
2 Đồng (Không 3) 2 (s) => 2 CuO (s) + 4 NO2 (g) + O2 (G)
Phương trình hóa học trên áp dụng cho muối khan; đối với muối ngậm nước, hơi nước cũng được tạo ra ở vế phải của phương trình.
Do màu sắc hấp dẫn của đồng nitrat, muối này được sử dụng làm chất kết dính trong gốm sứ, bề mặt kim loại, một số loại pháo hoa và ngành công nghiệp dệt may.
Đối với nhiều phản ứng, đặc biệt là đồng ion xúc tác các phản ứng hữu cơ, nó là một nguồn đồng ion tốt. Nó cũng được sử dụng tương tự như các nitrat khác và có thể được sử dụng như một chất diệt nấm, thuốc diệt cỏ hoặc làm chất bảo quản gỗ.
Công dụng chính và sáng tạo nhất của nó là để tổng hợp chất xúc tác CuO hoặc vật liệu có đặc tính cảm quang. Nó cũng được sử dụng như một thuốc thử cổ điển trong các phòng thí nghiệm giảng dạy để thể hiện phản ứng bên trong pin điện áp.
Ví dụ về phương trình phản ứng với H2O:
2Cu(NO3)2 + 2H2O → 2Cu + O2 + 4HNO3