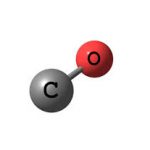
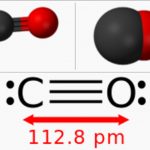
Carbon monoxide có công thức phân tử là CO, là một hợp chất khí vô cơ không màu, không mùi và không vị, nhẹ hơn không khí một chút. Độ hòa tan trong nước rất thấp, nhưng nó dễ dàng hòa tan trong nước amoniac.
Giới hạn nổ của hỗn hợp không khí là 12,5% ~ 74%. Carbon monoxide là sản phẩm của quá trình đốt cháy không hoàn toàn các vật liệu có thành phần carbon. Nó cũng có thể được sử dụng làm nhiên liệu than và nước có thể tạo ra khí nước (hỗn hợp khí carbon monoxide và hydro) ở nhiệt độ cao.
Một số công nghệ hiện đại, chẳng hạn như sản xuất sắt, vẫn tạo ra carbon monoxide như một sản phẩm phụ. Carbon monoxide là một trong ba loại khí có thể được cơ thể sử dụng để điều chỉnh tình trạng viêm một cách tự nhiên (hai khí còn lại là nitric oxide và hydrogen sulfide).
Vì ái lực của carbon monoxide và hemoglobin trong cơ thể lớn hơn 200-300 lần ái lực của oxy và hemoglobin, và tốc độ phân ly của carboxyhemoglobin chậm hơn 3600 lần so với oxyhemoglobin, khi nồng độ carbon monoxide đạt 35ppm trong không khí, nó sẽ gây tổn thương cho cơ thể con người, sẽ gây ra ngộ độc carbon monoxide (hay còn gọi là ngộ độc khí).
Mặc dù carbon monoxide là chất độc nhưng quá trình trao đổi chất của động vật cũng tạo ra một lượng nhỏ carbon monoxide, được cho là có một số chức năng sinh lý bình thường.
Khối lượng mol của cacbon monoxit là 28,0, nhẹ hơn khối lượng mol của không khí là 28,8. Ngọn lửa màu xanh lam được tạo ra khi đốt cháy cacbon monoxitde.
Trong công nghiệp, nguyên tắc cho cacbon đioxit phản ứng với cacbon ở điều kiện nhiệt độ cao thường được sử dụng để điều chế:
C + CO2 → 2CO
Trong phòng thí nghiệm, axit sunfuric đặc có thể được cho vào axit fomic để tạo cacbon monoxide.
Các phương trình hóa học của CO:
- CO khử CuO: CO + CuO → Cu _+ CO2
- CO khử oxit sắt trong lò cao: 4CO + Fe3O4 → 3Fe + 4CO2
- CO cháy trong không khí (cháy trong oxy): 2CO + O2 → 2CO2
- 3CO + Fe2O3 ⟶ 2Fe + 3CO2
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
Trong môi trường giữa các vì sao ngoài Trái đất, carbon monoxide rất phổ biến, và sự phân bố của nó rất rộng, chỉ đứng sau phân tử hydro, đứng thứ hai. Do tính bất đối xứng của các phân tử cacbon monoxide, quang phổ bức xạ sáng hơn nhiều so với các phân tử hydro nên dễ dàng phát hiện hơn.
Năm 1970, kính thiên văn vô tuyến lần đầu tiên phát hiện ra khí carbon monoxide trong không gian giữa các vì sao. Vì các phân tử hydro chỉ có thể được phát hiện bằng tia cực tím nên trong quá trình này phải sử dụng kính viễn vọng không gian.
Cho đến ngày nay, carbon monoxide đã trở thành chất đánh dấu được sử dụng phổ biến nhất khi phát hiện các phân tử trong thiên hà. Hầu hết quá trình hình thành sao xảy ra trong các đám mây phân tử, các nhà khoa học đã tăng cường hiểu biết của họ về các đám mây phân tử sau khi quan sát carbon monoxide.
Hiện nay, trong khí quyển, carbon monoxide là một lượng nhỏ khí, chủ yếu được tạo ra từ hoạt động núi lửa, nhưng nó cũng có thể được tạo ra từ các đám cháy tự nhiên và nhân tạo (như cháy rừng, đốt rơm rạ, mía đường để xua đuổi muỗi). Đốt nhiên liệu hóa thạch cũng tạo ra một lượng lớn khí carbon monoxide.