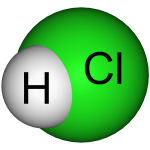
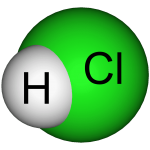
Axit clohydric có công thức hóa học là HCl, là một chất lỏng không màu và trong suốt. Axit clohydric là một axit vô cơ đơn bazơ mạnh và được sử dụng rộng rãi trong công nghiệp. Nó có mùi hăng nồng và có tính ăn mòn cao. Phần khối lượng của axit clohydric đậm đặc là khoảng 37%, rất dễ bay hơi.
Axit clohydric (axit clohydric dùng trong công nghiệp sẽ có màu hơi vàng do có lẫn tạp chất của muối sắt) là dung dịch nước chứa hiđro clorua và có mùi hăng. Nói chung, axit clohydric sử dụng trong phòng thí nghiệm là 0,1mol / L và pH = 1. Do axit clohiđric đậm đặc dễ bay hơi nên khí hiđro clorua bay hơi sẽ phản ứng với hơi nước trong không khí tạo thành các giọt axit clohiđric nhỏ nên sẽ nhìn thấy sương mù màu trắng.
Axit clohydric có thể trộn lẫn tùy ý với nước và etanol. Khi axit clohydric đậm đặc được pha loãng, nhiệt sẽ thoát ra và hiđro clorua có thể được hòa tan trong benzen.
Axit clohydric có thể tạo thành dung dịch azit dưới áp suất nhất định. Điểm sôi của các nồng độ khác nhau của axit clohiđric ở một áp suất khí quyển. Đường dưới và đường trên lần lượt biểu diễn các thành phần của chất lỏng và hơi ở trạng thái cân bằng với chất lỏng ở nhiệt độ tương ứng. Phần trăm khối lượng của hiđro clorua 20,24% tương ứng với nhiệt độ sôi cao nhất là 108,6 ° C.
Khi axit clohydric được hòa tan trong dung dịch kiềm, nó sẽ trung hòa với dung dịch kiềm. Axit clohydric là một axit đơn bazơ mạnh, có nghĩa là nó chỉ có thể ion hóa một.
Các phân tử hydro clorua bị ion hóa hoàn toàn trong dung dịch nước. Nó tạo phức với một phân tử nước và trở thành H 3O +, làm cho dung dịch nước có tính axit.
Có thể thấy anion sinh ra sau quá trình ion hóa là Cl – nên có thể dùng axit clohydric để điều chế clorua, chẳng hạn như natri clorua.
Axit clohydric có thể trung hòa axit và kiềm của natri hydroxit để tạo ra muối. Axit clohydric loãng có thể hòa tan nhiều kim loại (hoạt động của kim loại đi trước hiđro), và tạo ra clorua kim loại và hiđro.
Đồng, bạc, vàng và các kim loại khác hoạt động sau hiđro không thể phản ứng với axit clohydric loãng, nhưng đồng có thể tan chậm khi có không khí.
Trong hóa học trung học phổ thông, axit clohydric, axit sunfuric, axit nitric, axit hydrobromic, axit hydroiodic và axit pecloric được gọi chung là sáu axit vô cơ mạnh.
Axit đơn chức chỉ có một hằng số phân li axit, kí hiệu là Ka. Nó có thể đo độ mạnh của axit trong dung dịch nước. Đối với axit mạnh như axit clohydric, Ka rất lớn và chỉ có thể thu được bằng tính toán lý thuyết.
Khi thêm clorua (chẳng hạn như NaCl) vào dung dịch axit clohydric, độ pH về cơ bản không thay đổi, điều này là do Cl-là bazơ liên hợp của axit clohiđric và độ bền của nó cực kỳ yếu. Do đó, trong tính toán, nếu không xét dung dịch cực loãng, thì có thể giả định rằng nồng độ khối lượng của ion hydro giống như nồng độ hydro clorua ban đầu. Ngay cả khi nó chính xác đến bốn số liệu quan trọng, sẽ không có sai số.
Axit clohydric có tính khử và có thể phản ứng với một số chất oxi hóa mạnh để giải phóng khí clo. Một số bazơ oxi hóa và axit clohiđric có thể trải qua phản ứng oxi hóa khử thay vì phản ứng trung hòa đơn giản.
Ví dụ về phương trình hóa học:
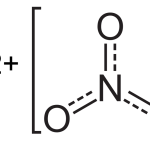
12HCl + 9Fe(NO3)2 → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
Phương trình ion: Fe2+ + H+ + NO3- => Fe3+ + NO + H2O