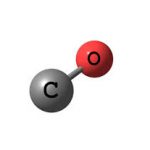
Carbon monoxide có công thức hóa học là CO, là một chất khí không màu, không mùi và không gây kích ứng. Ở điều kiện tiêu chuẩn, cacbon monoxide có khối lượng phân tử tương đối là 28,01, mật độ 1,25g / l, điểm đóng băng -205,1 ° C và điểm sôi -191,5 ° C. Độ hòa tan trong nước rất thấp và rất khó hòa tan trong nước.
Phân tử carbon monoxide là một phân tử bền không bão hòa, ổn định về mặt hóa học về mặt phân hủy. Ở nhiệt độ phòng, cacbon monoxide không phản ứng với axit, kiềm, … nhưng có thể tạo thành hỗn hợp nổ khi trộn lẫn với không khí, có thể gây cháy và nổ khi tiếp xúc với ngọn lửa trần và nhiệt độ cao, và là một chất khí dễ cháy và nổ.
Phản ứng oxy hóa (phản ứng đốt cháy): Khí cacbonic có thể cháy trong không khí hoặc khí oxi tạo ra khí cacbonic: khi cháy nó phát ra ngọn lửa màu xanh lam và tỏa nhiều nhiệt.
Phản ứng cân bằng (phản ứng phân hủy): Vì liên kết carbon-oxy trong phân tử carbon monoxide rất mạnh và đòi hỏi năng lượng hoạt hóa cao, carbon monoxide thực sự không thể bị phân hủy nếu không có xúc tác. Khi cacbon monoxide bị hấp phụ trên bề mặt tinh thể của một số chất, nó có thể bị phân hủy. Sắt đứng đầu trong số các chất này. Cơ chế phân hủy của cacbon monoxide có sự tham gia của sắt.
Phản ứng thay đổi: Ở những điều kiện nhất định, cacbon monoxide và hơi nước phản ứng như nhau để tạo ra hiđro và cacbon đioxit: CO + H2O → H2 + CO2
Trong các nhà máy công nghiệp, phản ứng chuyển dịch cacbon monoxide ban đầu thường được thực hiện qua hai giai đoạn là chuyển dịch nhiệt độ cao (trung bình) và chuyển dịch nhiệt độ thấp.
Phản ứng hydro hóa: Trong các điều kiện phản ứng và xúc tác khác nhau, quá trình hydro hóa cacbon monoxit có thể tổng hợp nhiều loại hợp chất hữu cơ, chẳng hạn như: tổng hợp metanol, tổng hợp metan (phản ứng metan hóa), tổng hợp etyl Glycol, polymethylene tổng hợp, v.v.
Phản ứng phối hợp: Carbon monoxide có thể phản ứng với hầu hết các kim loại chuyển tiếp để tạo thành cacbonyl kim loại và các dẫn xuất của chúng.
Ví dụ, ở nhiệt độ và áp suất bình thường, cacbon monoxide có thể phản ứng trực tiếp với bột niken kim loại hoạt động để tạo thành chất lỏng không màu niken tetracacbonyl [Ni (CO) 4]:; ở 200 ° C và 200 atm, cacbon monoxit có thể phản ứng với bột sắt tạo ra pentacacbonyl sắt [Fe (CO) 5]:
Trong điều kiện khắc nghiệt hơn, cacbon monoxide có thể phản ứng trực tiếp với coban, rhodi, đinh, molipđen và vonfram, nhưng hiệu suất thấp và không có giá trị thực tế.
Phản ứng với chất hữu cơ: Phản ứng với rượu:
- Cacbonyl hóa xúc tác metanol: phản ứng của cacbon monoxit và rượu có thể tạo ra axit cacboxylic, chẳng hạn như cacbonyl hóa có xúc tác metanol để tạo ra axit axetic: CO + CH3OH → CH3COOH.
- Cacbonyl hóa xúc tác bazơ mạnh: Được xúc tác bởi bazơ mạnh (NaOH), cacbon monoxit phản ứng với metanol tạo thành metyl fomat: CO + CH3OH → HCOOCH3
- Oxy hóa cacbonyl hóa: Ở nhiệt độ 90 ℃, áp suất khoảng 10 MPa và phản ứng hiếu khí, cacbon monoxit có thể phản ứng với metanol để tạo ra đimetyl cacbonat hoặc đimetyl oxalat: 2CO + 4CH3OH + O2 → 2 (CH3O) 2CO + 2H2O hoặc 4CO + 4CH3OH + O2 → 2CH3O-CO-CO-OCH3 + 2H2O. Nếu chất xúc tác clorua cốc được sử dụng, thì cacbonat được tạo thành; nếu chọn hỗn hợp clorua palađi và đồng clorua làm chất xúc tác, thì oxalat được tạo thành.
Các phương trình phản ứng khác: CO + H2 + CuO = H2CO3 + Cu