Axit sunfuric (công thức hóa học là H2SO4) còn được gọi là mẹ của ngành công nghiệp hóa chất. Đây là một axit khoáng mạnh, có tính ăn mòn cao. Axit sunfuric có thể hòa trộn với nước và giải phóng ở nồng độ bất kỳ. Đôi khi, trong quá trình sản xuất công nghiệp, axit sunfuric cũng có thể được nhuộm thành màu nâu sẫm để nâng cao cảnh giác của mọi người đối với chất này.
Là một axit bazơ, axit sunfuric có các đặc điểm khác nhau ở các nồng độ khác nhau và tính ăn mòn của nó đối với các chất khác nhau, chẳng hạn như kim loại, mô sinh học và thậm chí cả đá, được cho là do tính axit mạnh và độ mạnh của nó ở nồng độ cao. Mất nước (tính chất hóa học ), tính chất hút nước (tính chất vật lý) và tính chất oxi hóa.
Axit sunfuric có thể gây tổn hại lớn cho da và thịt, vì nó sẽ phân hủy protein và chất béo thông qua phản ứng thủy phân axit và gây bỏng hóa học, ngoài ra còn có phản ứng khử nước với carbohydrate và gây bỏng ngọn lửa thứ cấp. Ngoài ra, tính hút nước của axit sunfuric có thể được sử dụng để làm khô các khí không có tính kiềm.
Mặc dù axit sunfuric đặc và tinh khiết có thể được sản xuất và ổn định vô hạn ở nhiệt độ phòng (cái gọi là sự phân hủy thành azeotrope xảy ra ở nhiệt độ cao gần bằng nhiệt độ sôi), điểm nóng chảy của axit sunfuric tinh khiết quá cao (283,4K / 10,3 ° C), vì vậy để thuận tiện cho việc vận chuyển, người ta thường chế tạo axit sunfuric 98%.
Axit sunfuric cũng có giá trị y học nhất định. Ngoài ra nó còn có những công dụng rất lớn trong hóa học phân tích, ví dụ như axit sunfuric loãng thường được dùng trong chuẩn độ.
Axit sunfuric nguyên chất là một chất lỏng rất phân cực với hệ số điện môi xấp xỉ 100. Bởi vì các phân tử của nó có thể proton hóa lẫn nhau, dẫn đến độ dẫn điện cực cao, quá trình này được gọi là quá trình ion hóa tự ghép đôi.
Cơ chế phản ứng này giống như cơ chế phản ứng của axit photphoric và axit flohiđric nguyên chất. Nhưng thời gian cần thiết để axit sunfuric nguyên chất đạt đến trạng thái cân bằng của phản ứng này nhanh hơn nhiều so với hai phản ứng trên, gần như tức thời.
Sự hydrat hóa của axit sulfuric và nước là một phản ứng tỏa nhiệt cao, và dung dịch này rất dễ bắn tung tóe trong quá trình pha loãng, gây nguy hiểm. Do đó, nhiều hướng dẫn cho rằng người lao động nên cho axit từ từ vào nước chứ không nên đổ nước vào axit, một mặt do axit sunfuric có tỷ trọng lớn hơn nước nên việc cho nước vào axit sunfuric sẽ làm cho nước nổi trên axit sunfuric và mặt khác đun sôi và bắn tung tóe Vì điều này có thể tận dụng nhiệt dung riêng cao của nước, giảm rủi ro.
Do ái lực mạnh của axit sulfuric và nước và sự phối trí nhiệt động lực học của nó, nó là một chất khử nước mạnh có thể hút đi các phân tử nước trong hợp chất. Trong các phòng thí nghiệm, axit sulfuric thường được thêm vào đường trắng (sucrose) để thể hiện đặc tính khử nước mạnh của nó.
Phương trình hóa học của H2SO4:
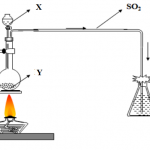
C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
CuO (s) + H2SO4 (aq)→ CuSO4 (aq) + H2O
KNO3 + H2SO4 → KHSO4 + HNO3
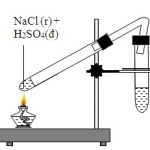
NaCl + H2SO4 → NaHSO4 + HCl
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O