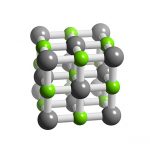
Nguyên tố hóa học kali được phân loại là một kim loại kiềm. Nó được phát hiện bởi Sir Humphrey Davey vào năm 1806. Ông phát hiện ra rằng các liên kết hóa học có bản chất là điện và ông có thể sử dụng điện để phân chia vật chất thành các khối cơ bản của nó – các nguyên tố hóa học.
Năm 1807, lần đầu tiên ông phân lập được kali tại Viện Hoàng gia ở London. Ông điện phân kali hydroxit khô (kali cacbonat) và đặt nó hơi ẩm trong không khí ẩm của phòng thí nghiệm. Quá trình điện phân được cung cấp bởi công suất kết hợp của ba cục pin lớn do ông chế tạo.
Khi đặt một hiệu điện thế lên kali hydroxit từ pin, ông nhận thấy rằng các hạt cầu tụ lại trên điện cực tích điện âm “có ánh kim loại cao.”
Tính chất vật lý
Khối lượng nguyên tử 39,0983
Trạng thái rắn
Điểm nóng chảy 63,4 ℃, 336,5 K
Điểm sôi 765,6 ℃, 1038,7 K
Số electron 19
Proton 19
Kali là kim loại đầu tiên được tách ra bằng điện phân. Tên gọi kali xuất phát từ từ tiếng Anh “kali cacbonat”, ban đầu có nghĩa là một chất kiềm chiết xuất bằng nước từ tro của gỗ hoặc lá đang cháy. Ký hiệu K cho kali xuất phát từ tên gọi của người Đức và Scandinavi là “kalium” cho nguyên tố kali.
Kali và natri trong bảng tuần hoàn là chất rắn ở nhiệt độ phòng. Tuy nhiên, hợp kim của chúng không phải vậy. Hợp kim NaK có chứa từ 40% đến 90% kali theo trọng lượng là chất lỏng ở nhiệt độ phòng. Hợp kim 78% K, 22% Na được bán trên thị trường vẫn ở dạng lỏng ở nhiệt độ thấp -12,6 ° C (9,3 oF).
Tất cả các tế bào sống đều cần kali để duy trì sự cân bằng chất lỏng, vì vậy chúng ta và tất cả các dạng sống khác trên Trái đất đều cần khoáng chất kali để tồn tại. Kali có trong tất cả các sản phẩm thịt, thực vật và sữa. Trái cây và rau quả là nguồn cung cấp kali tốt nhất.
Hầu hết các nguyên tử kali trong vũ trụ được tạo ra trong những khoảnh khắc cuối cùng của các ngôi sao khổng lồ trong các vụ nổ siêu tân tinh. Kali được tạo ra trong lớp vỏ bên ngoài của ngôi sao có tác dụng đốt cháy oxy khi nó phát nổ.
Tất cả thực vật đều cần kali để tồn tại; hơn 90% hợp chất kali được con người sử dụng để sản xuất phân bón cho cây trồng.
Kali là một kim loại màu trắng bạc, có độ nóng chảy thấp, đủ mềm để có thể dễ dàng cắt bằng dao. Nó nhanh chóng bị xỉn màu trong không khí, tạo thành một lớp phủ oxit xỉn màu.
Kali cháy với ngọn lửa hoa oải hương. Nó rất dễ phản ứng và phản ứng dữ dội với nước, ví dụ, tạo ra hydro và kali hydroxit.
Kali là một kim loại rất nhẹ (kim loại dày thứ hai sau liti), nó có thể nổi trên mặt nước nếu nó không phản ứng như vậy.
Kali cần thiết cho sự phát triển của cây. Ví dụ, thực vật sử dụng nó để tạo ra protein, vì vậy nhu cầu lớn nhất đối với các hợp chất kali là trong phân bón.
Kali hydroxit là một bazơ mạnh và là một hóa chất công nghiệp quan trọng. Nó được sử dụng để làm xà phòng mềm và làm chất điện phân cho pin kiềm.
Kali clorua là một chất thay thế lành mạnh cho muối ăn.
Kính cường lực có thể được chế tạo bằng cách nhúng kính vào dung dịch kali nitrat. Kali nitrat là thành phần nổ chính của thuốc súng.
Một ví dụ phản ứng liên quan: 2HCl + K2SO3 → H2O + SO2 + 2KCl
Phương trình ion rút gọn: 2H+ + SO32- → H2O + SO2