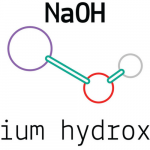
Natri hydroxit, còn được gọi là xút và xút ăn da, công thức hóa học là NaOH, là một bazơ mạnh có tính ăn mòn cao, thường là dạng vảy hoặc hạt màu trắng, hòa tan trong nước tạo thành dung dịch kiềm, và cũng hòa tan trong metanol và etanol.
Natri hydroxit là chất lỏng và hấp thụ hơi nước trong không khí, cũng như các khí axit như carbon dioxide và sulfur dioxide.
Natri hydroxit là một chất rắn màu trắng đục như sáp với tỷ trọng là 2,13. Nó có trọng lượng phân tử là 40,00, điểm nóng chảy là 318 ° C (591 K) và điểm sôi là 1388 ° C (1661 K).
Natri hydroxit có thể được hòa tan trong nước để tạo thành dung dịch kiềm, và cũng có thể được hòa tan trong metanol và etanol. Độ hòa tan trong nước là 111 g / 100 ml (20 ℃), độ hòa tan trong metanol là 238 g / L và độ hòa tan trong etanol là nhỏ hơn 139 g / L.
Natri hydroxit trong nước sẽ được phân ly hoàn toàn thành ion natri và ion hydroxit, có thể được trung hòa với axit bằng phản ứng axit-bazơ. Nó cũng có thể phản ứng với phenol có tính axit yếu.
Natri hydroxit dễ bị biến chất trong không khí vì nó phản ứng với khí cacbonic trong không khí. Xảy ra trong dung dịch, carbon dioxide dư thừa sẽ chuyển đổi natri cacbonat thành natri bicacbonat (thường được gọi là muối nở).
Không thể bảo quản natri hydroxit bằng nút thủy tinh. Bởi vì các sản phẩm thủy tinh có chứa silica, natri hydroxit sẽ phản ứng với nó để tạo thành natri silicat, làm cho piston trong dụng cụ thủy tinh dính vào dụng cụ và không thể sử dụng lại được. Do đó, các chai cổ hẹp đựng natri hydroxit thường được đậy kín bằng nút cao su. Nếu để dung dịch natri hydroxit nóng trong hộp thủy tinh lâu ngày, hộp thủy tinh sẽ bị hỏng, thậm chí bị vỡ.
Natri hydroxit cũng có thể phản ứng với crom trioxit, photpho pentoxit, asen trioxit, lưu huỳnh đioxit, selen đioxit và các oxit có tính axit khác để tạo thành muối của chúng.
Natri hydroxit có thể phản ứng với các oxit hoặc hydroxit lưỡng tính để tạo thành muối và nước. Bo, silic và các kim loại lưỡng tính (như berili, nhôm, kẽm, v.v.) phản ứng với natri hydroxit để giải phóng hydro. Clo, brom, iot, lưu huỳnh, phốt pho trắng và các nguyên tố khác và natri hydroxit trải qua phản ứng cân bằng.
Muối của các kim loại chuyển tiếp và một số kim loại nhóm chính có thể phản ứng với natri hydroxit để tạo thành nhiều hydroxit không hòa tan hơn, hoặc chuyển thành phức hydroxyl hòa tan để hòa tan lại.
Đối với các chất như thủy ngân, nơi không thể tồn tại ổn định hydroxit, oxit hoặc kết tủa hydrat của oxit được tạo ra.
Natri hydroxit có thể chuyển đổi các ion acyl của kim loại chuyển tiếp thành các gốc axit anion (ion đơn giản hoặc ion đa). Natri hydroxit phản ứng với muối amoni để tạo ra amoniac, nước và các muối natri tương ứng.
Natri hydroxit có thể phản ứng hydrocacbon halogen hóa, este và axit halogenua, trong đó tiêu biểu nhất là phản ứng xà phòng hóa.
Natri hydroxit là sản phẩm phụ của quá trình sản xuất clo trong công nghiệp, trong công nghiệp, khí clo được sản xuất hàng loạt bằng cách điện phân một lượng lớn nước muối bão hòa, tuy nhiên khi các ion clorua bị oxi hóa thành khí clo và thoát ra ngoài thì chỉ có natri hydroxit vẫn còn trong dung dịch.
Một số phương trình phản ứng:
NaOH + Cr(OH)3 → NaCrO2+ 2H2O
Phương trình ion rút gọn: OH- + Cr(OH)3 → CrO2- + 2H2O