Fe (OH) 2 là công thức hóa học của hydroxit đen, chất có khối lượng phân tử là 89,866, là chất rắn màu trắng, có tính bazơ mạnh trung bình, dễ tan trong axit, khó tan trong kiềm, dễ bị oxi hóa, rất ít tan trong nước, và dễ bị phân hủy khi đun nóng.
Hydroxit đen nguyên chất có màu trắng.Nhưng nó thường khó thấy, nó thường có màu xanh lục nhạt. Vì oxy hòa tan trong dung dịch và có sự trao đổi vật chất và năng lượng giữa hệ phản ứng (hệ hở) với thế giới bên ngoài, oxy trong không khí liên tục được hòa tan vào dung dịch, và hydroxit sắt mới tạo thành nhanh chóng bị oxy hóa thành hydro.
Oxit sắt nên trong quá trình thí nghiệm khó quan sát thấy kết tủa của hiđroxit sắt màu trắng, chỉ có hỗn hợp hiđroxit sắt bị oxi hóa và hiđroxit đen mới tạo thành: một số kết tủa màu xanh xám.
4Fe (OH) 2 + O2 + 2H2O = 4Fe (OH) 3
Nếu muốn điều chế Fe (OH) 2 nguyên chất ta thực hiện như sau: Cho dầu hỏa vào ống nghiệm, sau đó cho NaOH căng vào ống nghiệm. Có thể ngăn cản quá trình oxy hóa bằng O2.
Hydroxit sắt bản thân là một chất màu trắng, nhưng nó có thể bị oxy hóa thành hydroxit sắt, có màu nâu đỏ hoặc nâu đỏ. Đổ một lượng nhỏ dung dịch sunfat sắt vào ống nghiệm, nhỏ vài giọt dầu hỏa, dùng ống nhỏ giọt có đầu cao su đưa sâu xuống dưới bề mặt dung dịch rồi nhỏ giọt dung dịch natri hiđroxit vào, thấy kết tủa trắng bông tạo thành Fe. (OH) 2.
Fe (OH) 2 sinh ra dễ bị oxi hóa thành hiđroxit sắt trong dung dịch. Sau một thời gian để yên, lắc ống nghiệm thì kết tủa trong dung dịch chuyển sang màu xanh xám, cuối cùng là Fe (OH) 3 màu nâu đỏ.
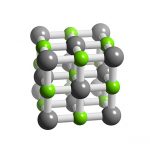
Clorua sắt là một clorua của sắt (II) với công thức hóa học là FeCl2. Nó là một chất rắn thuận từ có điểm nóng chảy cao, được kết tinh từ dung dịch nước để thu được tetrahydrat màu xanh lục, được sử dụng rộng rãi hơn nhiều so với anhydrat của nó.
Phương pháp phổ biến nhất được sử dụng là phản ứng với sắt và hydro clorua:
Fe + 2 HCl → FeCl2 + H2
Sử dụng dung dịch hydro clorua metanol làm nguyên liệu dễ dàng hơn là axit clohydric đậm đặc, phản ứng tạo ra solvat [Fe (MeOH) 6] Cl2, được đun nóng đến khoảng 160oC trong chân không để thu được FeCl2 tinh khiết.FeBr2 và FeI2 có thể được điều chế bằng các phương pháp tương tự.
Ngoài ra, clorua đen có thể được điều chế bằng cách cho FeCl3 khan phản ứng với clobenzen ở 126 ° C:
2FeCl3 + C6H5Cl → 2FeCl2 + C6H4Cl2 + HCl
FeCl2 được điều chế bằng phương pháp này dễ tan trong tetrahydrofuran.
Khi Jeffrey Wilkinson tổng hợp ferrocene, FeCl2 được tạo ra bằng cách nung nóng FeCl3 và bột sắt.
FeCl2 có thể tạo phức với nhiều phối tử, phổ biến nhất là hiđrat FeCl2 (H2O) 4 của nó, có thể được điều chế bằng cách cho nguyên liệu thải từ sản xuất thép phản ứng với axit clohydric.
1mol FeCl2 phản ứng với 2mol [(C2H5) 4N] Cl tạo thành muối [(C2H5) 4N] 2 [FeCl4]. Các muối của [MnCl4] 2−, [MnBr4] 2−, [MnI4] 2−, [FeBr4] 2−, [CoCl4] 2−, [CoBr4] 2−, [NiCl4] 2− và [CuCl4] 2− Cả hai đều có thể được chuẩn bị bằng các phương pháp tương tự.
Phương trình hóa học của Fe(OH)2 tác dụng với HCl:
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Phương trình ion rút gọn: Fe(OH)2 + 2H+ → Fe2+ + 2H2O