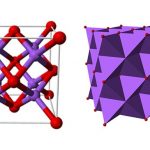
Kali (Kalium), ký hiệu nguyên tố K, số hiệu nguyên tử 19, nằm ở nhóm IA của chu kỳ 4 của bảng tuần hoàn, thuộc nguyên tố kim loại kiềm. Chất đơn giản là kim loại mềm màu trắng bạc, như sáp, có thể cắt bằng dao, có nhiệt độ nóng chảy thấp và tỷ trọng thấp hơn nước. Đặc tính hóa học của nó hoạt động hơn natri.
Kali không tồn tại như một chất đơn giản trong tự nhiên, Kali phân bố rộng rãi trong đất liền và đại dương dưới dạng muối, đồng thời nó cũng là một trong những thành phần quan trọng trong mô cơ và mô thần kinh của con người.
Muối kali đã được biết đến ở dạng muối (kali nitrat, KNO3), phèn (kali nhôm sunfat dodecahydrat, KAl (SO4) 2 · 12H2O), và tro thực vật (kali cacbonat, K2CO3) trong nhiều thế kỷ. Chúng được sử dụng trong sản xuất thuốc súng, nhiên liệu và xà phòng.
Việc khử các chất chứa kali thành các nguyên tố đã đánh bại các nhà hóa học ban đầu, và kali được Lavoisier phân loại là “đất”. Do tính linh động cao của kali, rất khó để khử kali kim loại từ các hợp chất của kali bằng các chất khử thường được sử dụng (như cacbon).
Tính chất hóa học của kali là hoạt động mạnh hơn natri, và chỉ yếu hơn xêzi và rubidi. Khi tiếp xúc với không khí, bề mặt nhanh chóng bị bao phủ bởi một lớp kali oxit và kali cacbonat, làm cho nó mất đi ánh kim loại (bề mặt có màu xanh tím), vì vậy kali kim loại cần được bảo quản trong parafin lỏng hoặc argon để ngăn ngừa quá trình oxy hóa.
Kali bốc cháy khi nung trong không khí, nung nóng trong một lượng oxi có hạn tạo ra kali oxit, khi đun nóng trong oxi dư tạo ra hỗn hợp kali peoxit và kali supeoxit. Kali kim loại tan trong amoniac lỏng tạo thành chất lỏng màu xanh đen, có thể dẫn điện, thực nghiệm cho thấy nó có chứa các amoniac hóa.
Kali có thể bị phân hủy thành hiđro và kali amit khi bảo quản lâu ngày hoặc dưới xúc tác của sắt. Dung dịch amoniac lỏng kali phản ứng với oxy để tạo ra kali superoxit, và ozon phản ứng để tạo ra kali ozonide màu đỏ cam.
Kali phản ứng dữ dội với nước và thậm chí có thể bắt lửa trên băng để tạo ra kali hydroxit và hydro. Nhiệt lượng tỏa ra trong quá trình phản ứng có thể làm tan chảy kim loại kali và làm cháy kali và hydro.
Kali có thể phản ứng với flo, clo, brom và iot để tạo thành halogenua tương ứng. Kali không tương tác với nitơ. Nó phản ứng với amoniac để tạo ra cacbamat và giải phóng hydro.
Kali và thủy ngân tạo thành hỗn hống kali (công thức hóa học: K + Hg = K [Hg]), là một chất khử và không phản ứng mạnh với nước. Phản ứng tỏa nhiệt mạnh xảy ra khi kali và thủy ngân tương tác. Trạng thái oxi hóa của kali là +1 và chỉ các hợp chất có hóa trị +1 mới được tạo thành.
Trong lĩnh vực hóa học phổ thông, người ta cho rằng các muối kali đều tan trong nước, nhưng thực tế kali peclorat, kali hiđro tartrat, kali hexachloroplatinat, natri coban kali nitrit, kali tetraphenylborat,… đều ít tan hơn.
Các phương trình hóa học:
2K + Cl2 → 2KCl
2K + Br2 → 2KBr
2K + I2 → 2KI
4K + O2 → 2K2O
2K + 2H2O → 2KOH + H2
2K + S → 2K2S
K + 2HCl → KCl + H2