Ferrous hydroxide (hydroxit sắt), công thức hóa học Fe (OH) 2, phân tử khối tương đối 89,866. Chất rắn màu trắng, không tan trong nước. Mật độ 3,4g / cm3. Dễ bị phân hủy bởi nhiệt. Nó là một bazơ trung bình và mạnh, dễ tan trong axit nhưng không tan trong kiềm. Dễ bị oxy hóa. Có thể thu được chất này bằng cách cho phản ứng với dung dịch kiềm mạnh và dung dịch muối sắt.
Tính tan trong nước: không tan trong nước
Mật độ: 3,4g / cm3
Xuất hiện: chất rắn màu trắng
Ứng dụng: dùng để làm bột màu, thuốc, dùng cho máy lọc nước
Hydroxit sắt [Fe (OH) 2] là chất rắn màu trắng ở nhiệt độ và áp suất thường, nhưng dễ bị oxi hóa thành Fe (OH) 3 nên phần lớn có màu nâu đỏ.
Oxit sắt thuộc hệ tinh thể lục phương, hằng số mạng a0 = 0,3258nm, c0 = 0,4605nm. Nó dễ bị oxy hóa thành màu nâu đỏ trong không khí. Nó hòa tan nhanh chóng trong axit loãng để tạo thành muối đen.
Hydroxit sắt là một chất khử mạnh trong dung dịch kiềm. Khi bột mịn hydroxit sắt được phun vào không khí, nó sẽ bốc cháy ngay lập tức và phát ra tia lửa. Tỷ trọng tương đối 3.4. Phân hủy khi đun nóng. Không tan trong dung dịch kiềm, không tan trong nước, tan trong amoni clorua.
Do oxi hòa tan trong dung dịch và hệ phản ứng (hệ hở) có sự trao đổi vật chất và trao đổi năng lượng với thế giới bên ngoài nên oxi trong không khí liên tục được hòa tan vào dung dịch, hydroxit sắt mới sinh ra nhanh chóng bị oxi hóa thành hiđro oxit sắt. nên trong quá trình thí nghiệm khó quan sát sự tạo thành kết tủa hydroxit sắt màu trắng, chỉ là sản phẩm trung gian của quá trình chuyển hóa hydroxit đen thành hydroxit sắt.
Một số kết tủa dạng bông màu xanh xám (Màu xanh xám thực chất là do hydroxit sắt hấp phụ các ion sắt trong dung dịch) và sau đó chuyển thành kết tủa hydroxit sắt màu đỏ.
4Fe (OH) 2 + O2 + 2H2O = 4Fe (OH) 3
2Fe (OH) 2 + O2 = △ = Fe2O3 + H2O
Không dễ kiếm được nguyên liệu tinh khiết, vì Fe (OH) 2 bị oxi hóa nhanh trong không khí, chuyển sang màu xanh xám và cuối cùng là hydroxit sắt đỏ nâu. Nếu hydroxit sắt được lọc ra trong môi trường khí không oxy hóa (như N2, H2 và các khí bảo vệ khác), rồi phun nhanh vào không khí, nó sẽ bốc cháy dữ dội hoặc thậm chí phát nổ.
Hầu hết các bazơ tan kém đều không tan trong dung dịch kiềm, ngoại trừ Fe (OH) 2 mới điều chế (tạo ra ion sắt hexahydroxy [Fe (OH) 6] 4). Hydroxit sắt lâu ngày không phản ứng với kiềm nên có thể giữ nguyên tính chất của Fe (OH) 2 trong môi trường kiềm và không trở thành Fe (OH) 3.
Và có thể phản ứng với axit nitric:
3Fe (OH) 2 + 10HNO3 = 3Fe (NO3) 3 + 8H2O + NO ↑
Phương pháp phòng thí nghiệm
① Điều chế sắt sunfat
Phản ứng với dung dịch đồng sunfat và sắt để tạo ra sunfat sắt và đồng, và phương trình phản ứng như sau:
CuSO4 + Fe == FeSO4 + Cu (loại phản ứng thuộc phản ứng thay thế)
② Điều chế hydroxit sắt
Với dung dịch sunfat sắt thu được và phản ứng natri hydroxit, tạo ra kết tủa hydroxit sắt và natri sunfat, lọc để lấy hydroxit sắt và phương trình phản ứng như sau:
FeSO4 + 2NaOH == Fe (OH) 2 ↓ + Na2SO4 (loại phản ứng thuộc phản ứng metathesis)
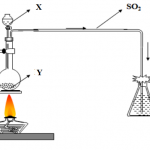
Phản ứng với H2SO4 được cân bằng theo thăng bằng e như sau:
2Fe(2+) -> 2Fe(3+) +2e
S(6+) + 2e -> S(4+)
Nhân chéo và rút gọn hệ số => Fe(2+) : S(4+) = 2:1
=> 2Fe(OH)2 + 4H2SO4đn -> Fe2(SO4)3 + SO2 + 6H2O