Ferroferric oxide là một chất vô cơ có công thức hóa học là Fe3O4, là một tinh thể màu đen có từ tính, vì vậy nó còn được gọi là oxit sắt từ tính. Nó không thể được coi là “ferit sắt” [Fe (FeO2), cũng như không thể được coi là hỗn hợp của oxit sắt (FeO) và oxit sắt (Fe2O3), nhưng nó có thể được coi là suboxit- 1 hợp chất bao gồm sắt và oxit sắt (FeO · Fe2O3).
Chất này không hòa tan trong nước, dung dịch kiềm, etanol, ête và các dung môi hữu cơ khác. Oxit ferroferric tự nhiên không tan trong dung dịch axit và dễ bị oxi hóa thành oxit sắt (Fe2O3) trong không khí ở trạng thái ẩm. Thường được sử dụng làm chất màu và chất đánh bóng, nó cũng có thể được sử dụng để sản xuất băng âm thanh và thiết bị viễn thông.
Ba oxit của sắt: oxit sắt (FeO), oxit sắt (Fe2O3) và oxit sắt (Fe3O4). Oxit sắt là hợp chất sắt duy nhất có thể từ hóa ở giai đoạn trung học cơ sở. Fe2 + và Fe3 + có trong oxit sắt từ. Thí nghiệm nhiễu xạ tia X cho thấy oxit sắt từ có cấu trúc trans-spinel, và không bao giờ có ion FeO22- trong tinh thể.
Ferroferric oxide, loại khoáng chất tự nhiên là magnetit. Sắt có hai hóa trị trong oxit ferroferric. Nó có cấu trúc trans-spinel, và oxy là khối có mật độ cao nhất. Ngoài ra Fe3O4 còn là chất dẫn điện Do Fe2 + và Fe3 + về cơ bản sắp xếp không trật tự ở vị trí bát diện trong magnetit nên các electron có thể chuyển nhanh giữa hai trạng thái oxi hóa của sắt nên Fe3O4 chất rắn sắt có tính dẫn điện rất tốt. Fe3O4 có thể được coi là FeO · Fe2O3, cách viết này tốt hơn cho thấy Fe3O4 có chứa Fe (Ⅱ) và Fe (Ⅲ).
Đốt dây sắt trong oxi sẽ tạo ra oxit sắt. So sánh số mol tiêu chuẩn của oxit sắt để sinh năng lượng tự do Gibbs, kết luận Fe3O4 có độ bền nhiệt động lớn nhất nên sản phẩm là Fe3O4. Sắt và không khí sẽ tạo thành oxit trên bề mặt của nó, lúc này thành phần hóa học của màng oxit không đồng nhất.
Ví dụ, một miếng thép cacbon thấp có thể được bao phủ bởi ba loại màng oxit: FeO tiếp xúc với kim loại, Fe2O3 ở phía tiếp xúc với không khí và Fe3O4 ở giữa. Chính xác hơn, có lẽ một hỗn hợp dung dịch rắn bão hòa của ba oxit tạo thành màng oxit trên bề mặt thép.
Đồng thời, độ dày của màng oxit cũng thay đổi tùy thuộc vào các điều kiện môi trường khác nhau trong quá trình oxi hóa. Ở nhiệt độ phòng, độ dày của oxit trên sắt tương đối tinh khiết trong không khí khô không vượt quá 20 angstrom (1 angstrom = 0,1 nanomet), nhưng độ dày của màng oxit trong không khí ẩm tăng lên đáng kể, và các vết gỉ trên bề mặt có thể được nhìn thấy.
Tại thời điểm này, sự lắng đọng oxit được phân lớp, phía gần kim loại là một lớp khan vô định hình dày đặc, và phía gần với không khí là một lớp hydrat hóa xốp dày.
Sắt phản ứng với hơi nước tạo ra Fe3O4 và hiđro. Fe3O4 có tác dụng chống ăn mòn.Ví dụ, nung các bộ phận bằng thép (còn gọi là nung xanh và nung xanh) là sử dụng tác dụng oxy hóa của dung dịch oxy hóa kiềm để tạo thành màng Fe3O4 màu xanh đen hoặc xanh đen trên bề mặt của các bộ phận bằng thép.Dùng để tăng khả năng chống ăn mòn, độ bóng và tính thẩm mỹ.
Ở nhiệt độ cao, nó dễ bị oxi hóa thành oxit sắt. 4Fe3O4 + O2 = Nhiệt độ cao = 6Fe2O3
Nó có thể phản ứng với các chất khử CO, Al, C, vv ở nhiệt độ cao. 3Fe3O4 + 8Al = Nhiệt độ cao = 4Al2O3 + 9Fe
Fe3O4 + 4CO = Nhiệt độ cao = 3Fe + 4CO2
Trong điều kiện đun nóng, nó có thể phản ứng với hydro chất khử. Fe3O4 + 4H2 = △ = 3Fe + 4H2O
Nitơ đioxit phản ứng với bột sắt nóng tạo ra oxit sắt và nitơ 3Fe + 2NO2 = nhiệt độ cao = Fe3O4 + N2
Sắt cháy trong oxi tạo ra oxit sắt 3Fe + 2O2 = bắt lửa = Fe3O4
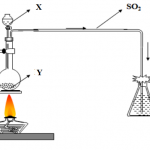
Sắt nóng phản ứng với hơi nước tạo ra oxit sắt 3Fe + 4H2O (g) = nhiệt độ cao = Fe3O4 + 4H2
Phản ứng với axit
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O