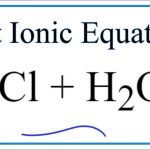Bạc nitrat là tinh thể không màu, có công thức hóa học là AgNO3, dễ tan trong nước. Bạc nitrat tinh khiết bền với ánh sáng, nhưng do độ tinh khiết của các sản phẩm thông thường là không đủ nên dung dịch nước và chất rắn của nó thường được đựng trong các chai thuốc thử màu nâu. Nó được sử dụng trong nhũ tương nhiếp ảnh, mạ bạc, làm gương, in ấn, y học, nhuộm tóc, kiểm tra clorua, bromua và iodua, vv. Nó cũng được sử dụng trong ngành công nghiệp điện tử.
Bạc nitrat là tinh thể vảy hình thoi không màu và trong suốt, dễ tan trong nước, tan trong ete và glycerin, ít tan trong etanol tuyệt đối, hầu như không tan trong axit nitric đậm đặc. Dung dịch nước của nó có tính axit yếu.
Vì dung dịch bạc nitrat có chứa một lượng lớn các ion bạc nên nó có tính oxy hóa và ăn mòn cao. Nó được sử dụng trong y tế để ăn mòn các mô hạt tăng sản, và dung dịch loãng được sử dụng như một chất diệt khuẩn đối với các bệnh nhiễm trùng mắt. Nó là chất lỏng màu vàng nhạt sau khi tan chảy, và vẫn có màu trắng sau khi đông đặc.
Khi đun nóng đến 440 ° C, bạc nitrat phân hủy thành bạc, nitơ, oxy và nitơ đioxit. Dung dịch nước và dung dịch etanol cho thấy phản ứng trung tính với quỳ tím, và độ pH là khoảng 6. Điểm sôi là 444 ° C (phân hủy). Nó đang bị oxy hóa. Khi có chất hữu cơ, ánh sáng chuyển sang màu xám hoặc xám đen.
Bạc nitrat có thể trải qua phản ứng kết tủa hoặc phản ứng phối trí với một loạt thuốc thử. Ví dụ, nó phản ứng với hydro sunfua để tạo thành kết tủa bạc sunfua Ag2S màu đen; phản ứng với kali cromat để tạo kết tủa bạc cromat Ag2CrO4 màu nâu đỏ; phản ứng với dinatri hydro photphat để tạo thành kết tủa bạc photphat Ag3PO4 màu vàng; phản ứng với các ion halogenua tạo thành một kết tủa AgX bạc halogenua.
Bạc nitrat có thể phản ứng với kiềm để tạo thành kết tủa bạc oxit Ag2O màu nâu đen; phản ứng với các ion oxalat để tạo kết tủa bạc oxalat Ag2C2O4 màu trắng. Bạc nitrat có thể phản ứng với NH3, CN-, SCN-, vv để tạo thành các phân tử phối trí khác nhau.
Phản ứng metathesis:
AgNO3 + HCl = AgCl ↓ + HNO3 (có thể dùng để thử chất có chứa ion clorua hay không)
2AgNO3 + 2NH3 + H2O = Ag2O ↓ + 2NH4NO3
2NaOH + 2AgNO3 = 2NaNO3 + Ag2O ↓ + H2O
NaCl + AgNO3 = AgCl ↓ + NaNO3
2AgNO3 + 2NH3 · H2O = Ag2O ↓ + H2O + 2NH4NO3 (một lượng nhỏ amoniac)
AgNO3 + 3NH3 · H2O = Ag (NH3) 2OH + NH4NO3 + 2H2O (amoniac dư)
HBr + AgNO3 = AgBr ↓ + HNO3 (kiểm tra ion bromua)
Phản ứng oxi hóa khử:
Bạc nitrat là một chất oxi hóa mạnh trung bình, có thể bị khử thành bạc nguyên tố bằng nhiều chất khử mạnh hoặc trung bình. Ví dụ, hydrazin N2H4 và axit photpho có thể khử AgNO3 thành bạc kim loại:
N2H4 + 4AgNO3 → 4Ag + N2 + 4HNO3
H3PO3 + 2AgNO3 + H2O → 2Ag + H3PO4 + 2HNO3
2AgNO3 + Cu = Cu (NO3) 2 + 2Ag (kim loại có hoạt tính mạnh hơn bạc có thể thay thế ion bạc trong dung dịch bạc nitrat)
Phương trình ion:
AgNO3 + NaCl → AgCl + NaNO3
Ag + + No3- + Na + + Cl- -> AgCl + Na + + NO3-
Bằng cách xác định “các ion bên ngoài”, bạn có thể tìm thấy các phương trình ion thuần, bắt đầu trong dung dịch và vẫn còn trong dung dịch sau phản ứng. Trong trường hợp này, chúng là Na + và NO3-.