Cân bằng phương trình
2FeO + 4H2SO4 → Fe2(SO4)3 + 4H2O + SO2
FeO + H2SO3 –> FeSO4 + H2
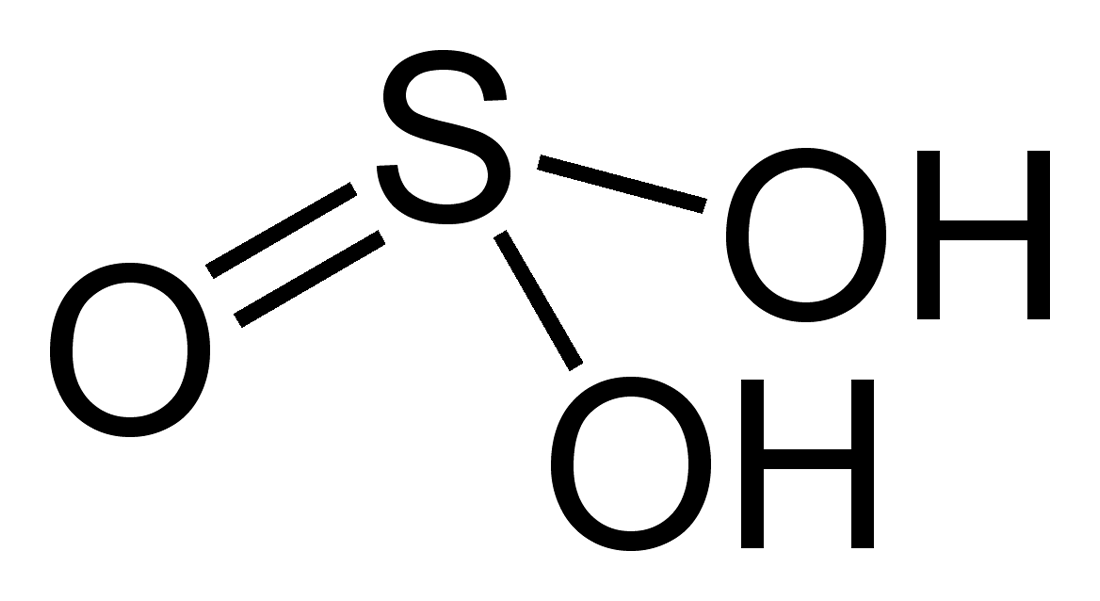
Tìm hiểu về H2SO3
Axit lưu huỳnh là gì?
H2SO3 là một hợp chất hóa học có tên hóa học là Axit lưu huỳnh.
Axit lưu huỳnh còn được gọi là dung dịch Sulfur dioxide hoặc dihydrogen trioxosulfate hoặc trioxosulfuric acid. Nó là loài trung gian tạo ra mưa axit từ lưu huỳnh đioxit (SO2).
Axit trioxosulfuric là chất lỏng không màu và có mùi lưu huỳnh cháy hắc. Nó ăn mòn mô và kim loại. Nó là một oxoacid lưu huỳnh, chất đồng phân của axit sulfonic và axit liên hợp của hydrogensulfite.
Tính chất của axit lưu huỳnh – H2SO3
H2SO3 Axit lưu huỳnh
Khối lượng phân tử của H2SO3 82,07 g / mol
Số chất nhận liên kết hydro 4
Khối lượng đơn vị của Axit lưu huỳnh 81,97 g / mol
Sử dụng axit lưu huỳnh (H2SO3)
Axit lưu huỳnh được sử dụng làm chất trung gian trong các ngành công nghiệp.
Dùng làm chất khử.
Dùng làm chất khử trùng.
Được sử dụng trong sản xuất các sản phẩm giấy.
Phản ứng axit lưu huỳnh
Theo phổ Raman của các dung dịch SO2 cho thấy cường độ của các tín hiệu phù hợp với trạng thái cân bằng như sau:
SO2 + H2O ⇌ HSO − 3 + H +
trong đó, Ka = 1,54 × 10−2 và pKa = 1,81.
Axit lưu huỳnh nguy hiểm cho sức khỏe
Nó là một hợp chất độc hại, ăn mòn và không cháy. Hít phải, nuốt phải hoặc để da tiếp xúc với dung dịch Sulfur dioxide gây thương tích nặng dẫn đến tử vong. Ở dạng nóng chảy, nó có thể gây bỏng nặng cho mắt và da. Do đó, tránh để da tiếp xúc với hợp chất này. Trên hợp chất này, nó giải phóng khí ăn mòn, độc hại và khó chịu.
Câu hỏi thường gặp – Câu hỏi thường gặp
Axit sunfurơ được sử dụng để làm gì?
Ở các nồng độ khác nhau, axit được sử dụng trong sản xuất phân bón, chất màu, thuốc nhuộm, thuốc, chất nổ, chất tẩy rửa, muối và axit vô cơ, cũng như trong các quy trình luyện kim và lọc dầu.
Axit sunfurơ là axit mạnh hay axit yếu?
Không giống như axit sunfuric (H2SO4), axit sunfurơ (H2SO3) là một axit yếu; nghĩa là, axit axit lưu huỳnh trong nước không phân ly hoàn toàn thành ion H + (H3O +) và bisulfit, có nghĩa là ion bisulfit tương đối mạnh hơn trong việc duy trì một proton khi có bazơ, chẳng hạn như nước.
Axit lưu huỳnh có nguy hiểm không?
Axit sulfuric có thể ảnh hưởng đến bạn bằng cách hít vào và di chuyển qua da của bạn. Axit lưu huỳnh là một chất ăn mòn, vì vậy tiếp xúc với mắt có khả năng bị tổn thương có thể gây kích ứng nghiêm trọng, do đó bỏng da và mắt. Hít thở Axit sulfuric có thể gây kích ứng cổ và họng.
Lưu huỳnh có phải là axit đơn chức không?
Không có axit đơn chức nào tồn tại. Có hai proton hydro ở trạng thái ban đầu, axit sunfuric (H2SO4), Nói cách khác, phân tử sunfat liên kết với một số proton có tính axit. Cũng lưu ý rằng các axit đơn chức sẽ chỉ đóng góp một proton có tính axit, không phải hai như trong axit này.
Axit sunfurơ có tan không?
Nó là một chất khí không màu, có độ hòa tan cao trong nước. Trong dung dịch, nó hyđrat hóa thành axit sulfuric (H2SO4), sau đó phân ly tạo thành các ion Bisulfit HSO4– và sulfit SO32-,.