Cân bằng phản ứng
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
Ca(HCO3)2 + 2CH3COOH → (CH3COO)2Ca + 2H2O + CO2
Tìm hiểu về CH3COOH
Axit Acetic là gì?
Axit axetic là một hợp chất hữu cơ có công thức CH3COOH. Nó là một axit cacboxylic bao gồm một nhóm metyl được gắn với một nhóm chức cacboxyl. Tên IUPAC có hệ thống của axit axetic là axit ethanoic và công thức hóa học của nó cũng có thể được viết là C2H4O2. Giấm là dung dịch axit axetic trong nước và chứa từ 5% đến 20% axit ethanoic theo thể tích. Mùi hăng và vị chua là đặc trưng của axit axetic có trong đó.
Dung dịch axit axetic không pha loãng thường được gọi là axit axetic băng. Nó tạo thành các tinh thể giống như băng ở nhiệt độ dưới 16,6oC. Nó có nhiều ứng dụng như một dung môi phân cực, protic. Trong lĩnh vực hóa học phân tích, axit axetic băng được sử dụng rộng rãi để ước tính các chất có tính kiềm yếu.
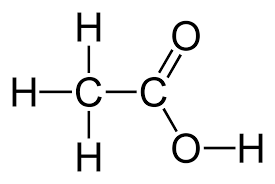
Cấu trúc của axit axetic-CH3COOH
Có thể quan sát thấy ở trạng thái rắn của axit axetic có một chuỗi phân tử trong đó các phân tử riêng lẻ được kết nối với nhau thông qua liên kết hydro.
Dime của axit ethanoic trong pha hơi của nó có thể được tìm thấy ở nhiệt độ xấp xỉ 120o
Ngay cả trong pha lỏng của axit ethanoic, các chất dimer của nó có thể được tìm thấy khi nó có mặt trong dung dịch loãng. Những chất dimer này bị ảnh hưởng bất lợi bởi dung môi thúc đẩy liên kết hydro.
Công thức cấu tạo của axit axetic được cho bởi CH3 (C = O) OH, hoặc CH3CO2H
Tính chất của axit axetic-CH3COOH
Axit axetic CH3COOH
Khối lượng phân tử / khối lượng mol của CH3COOH 60,052 g / mol
Mật độ Acetamide 1,05 g / cm³
Điểm sôi của axetamit 118 ° C
Điểm nóng chảy của axetamit 16,6 ° C
Điều chế axit axetic-CH3COOH
Axit axetic được sản xuất trong công nghiệp thông qua quá trình cacbonyl hóa metanol. Dưới đây là các phương trình hóa học cho ba bước liên quan đến quá trình này.
CH3OH (metanol) + HI (hydro iotua) → CH3I (chất trung gian metyl iodua) + H2O
CH3I + CO (cacbon monoxit) → CH3COI (axetyl iodua)
CH3COI + H2O → CH3COOH (axit axetic) + HI
Ở đây, một chất trung gian metyl iodua được tạo ra từ phản ứng giữa metanol và hydro iodua. Chất trung gian này sau đó được phản ứng với cacbon monoxit và hợp chất tạo thành được xử lý bằng nước để tạo ra sản phẩm axit axetic. Điều quan trọng cần lưu ý là phải sử dụng phức hợp cacbonyl kim loại làm chất xúc tác cho bước 2 của quá trình này.
Các phương pháp điều chế axit axetic khác
Một số muối naphthalene của coban, crom và mangan có thể được sử dụng làm chất xúc tác kim loại trong quá trình oxy hóa acetaldehyde. Phương trình hóa học của phản ứng này có thể được viết dưới dạng:
O2 + 2CH3CHO → 2CH3COOH
Ethylene (C2H4) có thể bị oxy hóa thành axit axetic với sự trợ giúp của chất xúc tác palađi và axit dị trùng hợp, như được mô tả bằng phản ứng hóa học sau đây.
O2 + C2H4 → CH3COOH
Một số vi khuẩn kỵ khí có khả năng chuyển hóa trực tiếp đường thành axit axetic.
C6H12O6 → 3CH3COOH
Có thể lưu ý rằng không có chất trung gian etanol nào được hình thành trong quá trình lên men kỵ khí đường bởi các vi khuẩn này.
Tính chất vật lý của axit axetic
Mặc dù axit ethanoic được coi là một axit yếu, nhưng ở dạng cô đặc, nó có khả năng ăn mòn mạnh và thậm chí có thể tấn công da người nếu tiếp xúc với nó. Một số tính chất chung của axit axetic được liệt kê dưới đây.
Axit etanoic là chất lỏng không màu, có mùi hắc.
Ở STP, điểm nóng chảy và điểm sôi của axit ethanoic lần lượt là 289K và 391K.
Khối lượng mol của axit axetic là 60,052 g / mol và khối lượng riêng của nó ở thể lỏng là 1,049 g.cm-3.
Nhóm chức cacboxyl trong axit ethanoic có thể gây ion hóa hợp chất, được cho bởi phản ứng: CH3COOH ⇌ CH3COO– + H +
Sự giải phóng proton, được mô tả bởi phản ứng cân bằng ở trên, là nguyên nhân gốc rễ của chất axit axetic.
Hằng số phân li axit (pKa) của axit ethanoic trong dung dịch nước là 4,76.
Bazơ liên hợp của axit axetic là axetat, cho bởi CH3COO–.
PH của dung dịch axit ethanoic có nồng độ 1,0M là 2,4, có nghĩa là nó không phân ly hoàn toàn.
Ở dạng lỏng, axit axetic là dung môi phân cực, protic, với hằng số điện môi là 6,2.
Sự chuyển hóa của cacbohydrat và chất béo ở nhiều loài động vật tập trung xung quanh liên kết của axit axetic với coenzyme A. Nói chung, hợp chất này được tạo ra thông qua phản ứng giữa metanol và cacbon monoxit (cacbonyl hóa metanol).
Tính chất hóa học của axit axetic
Các phản ứng hóa học xảy ra với axit axetic cũng tương tự như các phản ứng hóa học của các axit cacboxylic khác. Khi được đun nóng đến nhiệt độ trên 440oC, hợp chất này bị phân hủy để tạo ra metan và cacbon đioxit hoặc nước và etilen, như được mô tả bằng các phương trình hóa học sau đây.
CH3COOH + Đun nóng → CO2 + CH4
CH3COOH + Đun nóng → H2C = C = O + H2O
Một số kim loại như magiê, kẽm và sắt bị ăn mòn khi tiếp xúc với axit axetic. Những phản ứng này dẫn đến sự hình thành các muối axetat.
2CH3COOH + Mg → Mg (CH3COO) 2 (magiê axetat) + H2
Phản ứng giữa axit ethanoic và magiê dẫn đến sự hình thành magiê axetat và khí hydro, như được mô tả bằng phương trình hóa học ở trên.