Cân bằng phương trình
Cr + 2HCl → H2 + CrCl2
HCl + Sn → H2 + SnCl2
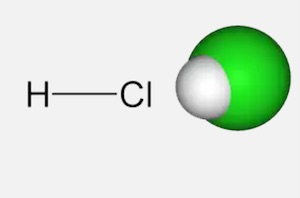
Tìm hiểu về HCl
Trong Hóa học, mặc dù Hiđro Clorua và Clo là những nguyên tố khác nhau nhưng chúng ta vẫn có xu hướng nghiên cứu chúng cùng nhau. Bên cạnh đó, chúng có mối quan hệ chặt chẽ với nhau, ví dụ, hầu hết HCl được tạo ra dưới dạng đồng sản phẩm của các phản ứng liên quan đến clo. Vì vậy, điều này về cơ bản khiến chúng ta mong muốn xem xét hai chất hóa học với nhau. Nói như vậy, ở đây chúng ta sẽ xem xét các phương pháp điều chế Hydro clorua và Clo.
A-xít clohidric
Hiđro clorua lần đầu tiên được điều chế vào năm 1648 bởi Glauber bằng cách đun nóng natri clorua với H2SO4 đặc
Vào năm 1840, Davy chỉ ra rằng HCl là hợp chất của clo và hiđro. Tên thông thường của axit clohydric là axit muriatic.
Điều chế hydro clorua
Axit Muriatic được điều chế bằng cách đun nóng tinh thể NaCl với H2SO4 đặc (Axit sunfuric).
Thông thường, hầu hết hydro clorua / axit clohydric được tạo thành là đồng sản phẩm của một số phản ứng hóa học khác. HCl cũng được tạo thành do quá trình clo hóa các hydrocacbon.
Tính chất của Hydrogen clorua
HCl là chất khí không màu, có mùi thơm hắc.
Axit clohydric là dung dịch nước của hydro clorua.
HCl tan trong nước.
Nó hóa lỏng ở 189K để tạo thành một chất lỏng không màu và đóng băng ở 159k để tạo thành một chất rắn màu trắng.
Công dụng của Hydrogen Clorua
HCl được sử dụng để điều chế clo, nước cường toan và các clorua khác.
Nó được sử dụng như một dung môi để hòa tan các khí quý.
Nó hoạt động như một chất phản ứng trong phòng thí nghiệm.
Clo
Clo có số hiệu nguyên tử là 17 và chiếm nhóm 17, chu kỳ 3 trong bảng tuần hoàn. Hóa học đằng sau clo đóng một vai trò quan trọng trong việc đáp ứng các yêu cầu hàng ngày. Đồng thời, các nhà khoa học trên khắp thế giới nghiên cứu những tiến bộ trong năng lượng tái tạo và thuốc hiện đại. Vào năm 1774, Scheele đã phát hiện ra sự có mặt của khí màu vàng lục này bằng cách quan sát tác dụng của HCl với MnO2. Khí này không được đặt tên cho đến khi Davy bắt nguồn từ mô tả cơ bản của nó và đề xuất tên dựa trên màu sắc của khí.
Điều chế Cl2
Khí này có thể được điều chế bằng bất kỳ quá trình nào sau đây:
Khi đun nóng Mangan đioxit với HCl đặc.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Kết luận Axit HCl có thể được thay thế bằng sự kết hợp của conc. H2SO4 và muối thường.
4NaCl + MnO2 + H2SO4 → MnCl2 + 4NaHSO4 + 2H2O + Cl2
HCl tác dụng với thuốc tím tạo ra
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Các quy trình khác để điều chế Clo.
Quá trình điện phân: Trong quá trình này, nước muối trải qua quá trình điện phân. Nước muối là dung dịch natri clorua đậm đặc. Sau khi điện phân Cl2 bị phóng điện ở anot.
Phương pháp Deacon’s: Trong phương pháp này Cl2 thu được bằng cách oxi hóa khí HCl bằng oxi có mặt chất xúc tác. CuCl2 đóng vai trò là chất xúc tác trong quá trình này ở 723k.
Tính chất của Cl2
Cl2 là chất khí có màu vàng lục, mùi hắc.
Bản chất của khí là độc.
Khí sôi ở 239,11K và nóng chảy ở 171,6K.
Nước clo được tạo thành khi Cl2 hòa tan trong nước. Màu vàng của nước bị biến mất khi tiếp xúc với ánh sáng mặt trời do sự tạo thành axit hipoclorơ và HCl. Axit hipoclorơ được tạo thành này không ổn định, do đó nó bị phân hủy để tạo ra oxy mới sinh, chịu trách nhiệm cho hoạt động tẩy trắng và oxy hóa của Cl2.
Cl2 + H2O → HCl + HOCl
HOCl → HCl + [O]
Cl2 có bản chất là độ âm điện lớn
Cl2 có ái lực lớn với hydro. Nó phản ứng với hydro để tạo thành HCl.