Cân bằng phản ứng
5HNO3 + P → H2O + 5NO2 + H3PO4
2H2O + 5HNO3 + 3P → 5NO + 3H3PO4
Tìm hiểu về H3PO4
Axit photphoric là gì?
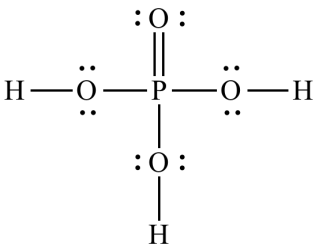
Axit orthophosphoric dùng để chỉ axit photphoric. Axit photphoric là một axit yếu với công thức hóa học là H3PO4.
Axit photphoric là một axit có chứa 4 nguyên tử oxy, một nguyên tử photpho và 3 nguyên tử hydro. Nó còn được gọi là axit photphoric (V) hoặc axit orthophotphoric. Nó có trong răng và xương giúp hỗ trợ quá trình trao đổi chất. Ở dạng lỏng, nó xuất hiện dưới dạng dung dịch trong suốt, không màu và ở dạng rắn, nó xuất hiện như chất rắn kết tinh, trong suốt.
Là một chất cô lập, nó giúp liên kết các cation hóa trị hai. Nó được sử dụng rộng rãi trong chỉnh hình răng và nha khoa. Axit photphoric rất quan trọng trong hóa sinh và hóa sinh. Nó là một axit tribasic. Cả ba hiđro đều có tính axit, giá trị pKa của hiđro thứ nhất, thứ hai và thứ ba lần lượt là pKa1 = 2,14, pKa2 = 7,20 và pKa3 = 12,37
Tính chất vật lý của axit photphoric (H3PO4)
Axit photphoric H3PO4
Khối lượng phân tử / Khối lượng mol 97,994 g / mol
Mật độ 1,88 g / cm³
Điểm sôi 158 ° C
Điểm nóng chảy 42,35 ° C
Axit photphoric là chất lỏng nhớt không mùi, không màu, có tính chất làm đỏ quỳ tím ở mức độ cao. Nó không thể được lấy từ nước.
Khi tiếp xúc với nhiệt màu đỏ và sau đó được làm lạnh, nó tạo thành một thủy tinh giòn trong suốt.
Sự phản ứng tổng hợp này phải được thực hiện trong chén bạch kim vì axit photphoric khi bị nung nóng sẽ đỏ lên tấn công thủy tinh hoặc sứ.
Axit nếu được kiểm tra sau khi tiếp xúc với nhiệt sẽ được tìm thấy mặc dù thành phần của nó vẫn giữ nguyên để có được các đặc tính mới.
Trên tài khoản này, tên của para photphoric đã được đặt cho nó; trong khi thuật ngữ photphoric được áp dụng để chỉ định axit ở trạng thái được mô tả đầu tiên.
Nitrat bạc tạo ra kết tủa màu vàng với axit para photphoric tạo kết tủa màu trắng. Albumen được đông tụ bởi chất sau nhưng không được đông tụ bởi chất trước.
Điều chế axit photphoric
Nó có thể được chuẩn bị thuận tiện bằng cách hòa tan P2O5 trong nước, sau đó đun sôi dung dịch để tạo thành xi-rô đặc.
P2O5 + 3H2O → 2H2PO4
Photpho đỏ khi đun nóng với HNO3 đặc tạo ra axit orthophosphoric.
P + 5HNO3 → H3PO4 + H2O + 5NO2
Ở quy mô lớn, nó được điều chế bằng cách xử lý đá photphorit với loãng.H2SO4.
Ca3 (PO4) 2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Tổng hợp axit photphoric – H3PO4
Có thể thu được axit photphoric bằng cách thêm axit sunfuric vào photphat của baryta lơ lửng trong nước.
Axit sunfuric hợp nhất với baryta tạo thành một muối không tan, kết tủa trong khi axit photphoric vẫn còn trong dung dịch.
Khi cho phốt pho dần dần vào axit nitric, axit photphoric được tạo ra và vẫn hòa trộn với axit nitric dư.
Tính chất hóa học của axit photphoric (H3PO4)
Axit photphoric là một chất rắn hóa lỏng, thường gặp ở dạng dung dịch nước nhớt.
Nó có tính axit yếu, có thể có ba bước deroto hóa tuần tự, tạo thành phốt phát.
Giống như axit cacboxylic, axit photphoric có thể đime hóa thông qua phản ứng khử nước để tạo thành anhydrit photpho.
Axit photphoric được gọi là axit bazơ, trong đó nó có ba bước phân ly có thể xảy ra.
Kết quả là các muối mono, dinatri và kali của axit photphoric thường được sử dụng làm chất đệm pH.
Một trong những phản ứng quan trọng nhất của axit photphoric và các dẫn xuất của nó là phản ứng trùng hợp.
Giống như với axit cacboxylic, hai phân tử axit photphoric có thể kết hợp với sự mất nước để tạo thành một este di photphat còn được gọi là pyrophosphat.
Tuy nhiên, vì axit photphoric có các chức năng -OH hơn nữa, các triphosphat cũng có thể được hình thành.
Muối của axit photphoric là chất rắn và nhiều loại tương đối không tan trong nước trừ khi có mặt axit khoáng mạnh.
Tính cơ bản của axit Orthophosphoric (H3PO4)
Tính bazơ của axit được biểu thị bằng số nguyên tử hydro có thể được thay thế bằng nguyên tử điện dương. Tính bazơ của axit là số ion hydro có thể được tạo ra bằng cách ion hóa một phân tử axit trong dung dịch nước của axit đó.
Một axit tạo ra ba ion hydro hoặc hydronium bằng cách ion hóa một phân tử của axit, được gọi là axit tribasic hoặc axit tri protic. Ví dụ, H3PO4 và H3PO3 là axit bazơ.