Cân bằng phương trình
12H2O + Al4C3 → 4Al(OH)3 + 3CH4
12H2O + 4NaOH + Al4C3 → 3CH4 + 4NaAl(OH)4
Tìm hiểu về CH4
Metan CH4
CH4 là một hiđrocacbon no đơn giản nhất có công thức hóa học CH4. Nó bao gồm bốn nguyên tử hydro và một nguyên tử carbon và là ankan đơn giản nhất.
Khi mêtan tự nhiên đến bề mặt của khí quyển được gọi là mêtan trong khí quyển và có thể được tìm thấy dưới đáy biển cũng như dưới mặt đất.
Nó không mùi hoặc có mùi dầu ngọt và không có màu. Nó là một khí không độc hại dễ cháy. Nó là một phân tử tứ diện có bốn liên kết C-H tương đương. Nó được tạo ra bởi vi khuẩn kỵ khí ruột kết. Alessandro Volta, một nhà vật lý người Ý là người đầu tiên xác định được mêtan một cách khoa học vào năm 1776.
Tính chất của Metan – CH4
Khí mê-tan là một trong những khí nhà kính quan trọng nhất và khoảng 70% lượng khí mê-tan phát thải có liên quan đến các hoạt động của con người. Khí mêtan tinh khiết là nguồn cung cấp thức ăn chăn nuôi giàu năng lượng với mật độ năng lượng là 55,7 MJ / kg và được sử dụng để tạo ra điện, để sưởi ấm và nấu ăn trong nhà
CH4 Metan
Khối lượng phân tử / Khối lượng mol 16,04 g / mol
Mật độ 0,656 kg / m³
Điểm sôi −161,50 ° C
Điểm nóng chảy −182,5 ° C
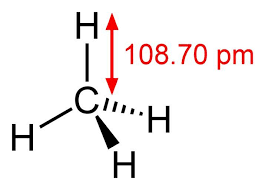
Cấu trúc mêtan – CH4
Cấu trúc mêtan
Cấu trúc mêtan
Sử dụng CH4 (Mêtan)
Nó được sử dụng trong ô tô, lò nướng và máy nước nóng làm nhiên liệu
Nó được sử dụng trong sản xuất điện
Nó được sử dụng làm nhiên liệu tên lửa ở dạng lỏng tinh chế của nó
Nó được sử dụng như một thành phần chống đông trong các ngành công nghiệp
Nó là một thành phần phổ biến trong phân bón
Nó được sử dụng để khử trùng các sản phẩm
Nó được sử dụng trong các nhà máy điện chạy bằng khí đốt
Nó được sử dụng trong bếp ga
Nó được sử dụng trong thử nghiệm các thiết bị khí đốt
Tetracyanomethane
Tetracyanomethane hoặc carbon tetracyanide là một nitride carbon phân tử percyanoalkane với công thức C (CN) 4. Cấu trúc có thể được coi là mêtan với tất cả các nguyên tử hydro được thay thế bằng các nhóm xyanua.
Tetracyanomethane, C (CN) 4, là một phân tử tứ diện chứa một cacbon sp3 trung tâm được điều phối bởi các nhóm nitril phản ứng có khả năng biến đổi thành mạng CN mở rộng với một phần đáng kể cacbon sp3. C (CN) 4 có độ tinh khiết cao đã được tổng hợp, và hành vi sinh lý của nó đã được nghiên cứu bằng cách sử dụng bột phân tán góc tại chỗ đồng bộ hóa tại chỗ (PXRD) và phổ Raman và tia hồng ngoại (IR)
Câu hỏi thường gặp – Câu hỏi thường gặp
Khí mêtan có hại cho con người không?
Riêng mêtan không độc nhưng có thể gây chết người khi trộn lẫn với các khí khác. Khí mêtan chiếm chỗ của ôxy để gây ra ngạt thở. Nó có thể gây ra các triệu chứng chóng mặt và đau đầu, nhưng những triệu chứng này thường không được chú ý cho đến khi não báo hiệu cơ thể đang thở hổn hển.
Nguyên nhân chính gây ra khí mêtan là gì?
Khí mêtan được giải phóng trong quá trình sản xuất và vận chuyển than, khí đốt tự nhiên và dầu mỏ. Phát thải khí mê-tan cũng do chăn nuôi và các hoạt động trồng trọt khác và sự suy thoái chất thải nông nghiệp tại các bãi chôn lấp chất thải rắn đô thị.
Tại sao khí mêtan có hại cho môi trường?
Ví dụ, nếu khí mêtan tràn vào không khí trước khi được sử dụng từ một đường ống bị rò rỉ – nó sẽ hấp thụ nhiệt từ mặt trời, làm bầu khí quyển nóng lên. Nó được gọi là khí nhà kính, như carbon dioxide, vì lý do này.
Mêtan có phải là nhiên liệu hóa thạch không?
Nhiên liệu hóa thạch có nhiều loại từ vật liệu dễ bay hơi với tỷ lệ carbon trên hydro thấp (như mêtan), chất lỏng (như dầu mỏ), đến vật liệu không bay hơi gần như tinh khiết có thành phần carbon, chẳng hạn như than antraxit. Mêtan có thể được tìm thấy đơn lẻ, kết hợp với dầu, hoặc ở dạng các clorua mêtan trong các mỏ hydrocacbon.
Metan có thể được chiết xuất từ khí quyển không?
Sau đó, vi khuẩn có thể được sử dụng để tách khí mê-tan từ không khí. Do tính hiệu quả mạnh mẽ của nó như một loại khí nhà kính, Boucher và Folberth tuyên bố rằng việc loại bỏ khí mê-tan có thể cạnh tranh về mặt tài chính với việc thu giữ các-bon, ngay cả khi bản thân các công nghệ này đắt hơn.