Liti là một nguyên tố kim loại, ký hiệu nguyên tố là Li, nguyên tố tương ứng là kim loại mềm màu trắng bạc, đồng thời nó cũng là kim loại có khối lượng riêng nhỏ nhất. Được sử dụng trong lò phản ứng nguyên tử, hợp kim nhẹ và pin.
Liti và các hợp chất của nó không điển hình như các kim loại kiềm khác, bởi vì mật độ điện tích cao và lớp điện tử kép ổn định kiểu helium của Liti làm cho nó dễ dàng phân cực các phân tử hoặc ion khác, nhưng bản thân nó không thay đổi. Điều này ảnh hưởng đến sự ổn định của nó và các hợp chất của nó.
Với thế điện cực âm nhất, liti là kim loại di động nhất trong số các nguyên tố đã biết, kể cả nguyên tố phóng xạ.
Tính chất vật lý
Liti là kim loại màu trắng bạc, chất lượng mềm và có thể cắt bằng dao. Liti là kim loại nhẹ nhất và tỷ trọng của nó nhỏ hơn so với tất cả các loại dầu và hydrocacbon lỏng, vì vậy nó nên được bảo quản trong parafin rắn hoặc xăng dầu trắng (liti cũng sẽ nổi trong parafin lỏng).
Khối lượng riêng của liti rất nhỏ, chỉ 0,534g / cm³, nhỏ nhất trong số các nguyên tố không ở dạng khí.Do bán kính nguyên tử nhỏ nên liti có khả năng nén thấp nhất, độ cứng cao nhất và nhiệt độ nóng chảy cao nhất so với các kim loại kiềm khác.
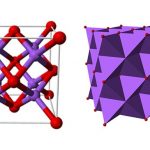
Khi nhiệt độ cao hơn -117 ° C, liti kim loại là một cấu trúc lập phương tâm diện điển hình, nhưng khi nhiệt độ giảm xuống -201 ° C, nó bắt đầu chuyển thành cấu trúc lập phương tâm mặt. Nhiệt độ càng thấp , mức độ biến đổi càng lớn, nhưng biến đổi không hoàn toàn. Ở 20 ° C, liti có hằng số mạng là 3,50 Å và độ dẫn điện bằng một phần năm so với bạc. Lithium dễ dàng hợp nhất với bất kỳ kim loại nào khác ngoài sắt.
Mặc dù thế tiêu chuẩn hiđro của liti là âm nhất, đạt -3.045, nhưng do độ hòa tan của liti hiđroxit không lớn và nhiệt tỏa ra không thể làm tan chảy liti khi phản ứng với nước nên phản ứng giữa liti và nước không bằng bạo lực như natri, và phản ứng đang diễn ra.
Sau một thời gian, màng nitơ oxit trên bề mặt liti bị hòa tan, làm cho phản ứng trở nên dữ dội hơn. Nó dễ dàng phản ứng với hiđro ở khoảng 500 ° C để tạo ra hiđrua liti, đây là kim loại kiềm duy nhất có thể tạo ra hiđrua đủ bền để nóng chảy mà không bị phân hủy. Kim loại kiềm phản ứng với nitơ ở nhiệt độ phòng để tạo ra liti nitrua (Li₃N) .
Liti là một nguyên tố hóa học và là một kim loại có hoạt tính kim loại mạnh (kim loại mạnh nhất là xêzi).
Li ti sẽ bị sậm màu do dễ bị oxi hóa. Nếu thả liti vào axit sunfuric đặc, liti sẽ nhanh chóng nổi trên mặt axit sunfuric, cháy và nổ. Nó cũng có khả năng phản ứng bùng nổ nếu lithium và kali clorat được trộn lẫn (lắc hoặc xay).
Lithi hiđrua phản ứng mạnh với nước, tạo ra một lượng lớn hydro. Sau khi hai kilogam liti hiđrua bị phân hủy, có thể giải phóng được 5,66 kilôgam hiđro. Lithium hydride thực sự là một “nhà máy sản xuất hydro” rất xứng đáng.
Một số phản ứng của Liti:
6Li + N2 → 2Li3N
2Li + 2H2O → 2LiOH + H2