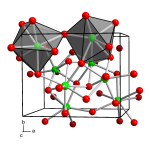
Ba(OH)2 là bari hydroxit, là tinh thể trong suốt không màu hoặc bột trắng. Trong máy sấy axit sulfuric, 7 phân tử nước tinh thể có thể bị mất và tất cả nước tinh thể bị mất ở khoảng 78 ° C.
Bari hydroxit hòa tan trong nước, metanol, ít tan trong etanol, hầu như không tan trong axeton. Nếu carbon dioxide được hấp thụ nhanh chóng từ không khí và biến thành cacbonat, nó không thể hòa tan hoàn toàn trong nước.
Bari hydroxit có tỷ trọng tương đối 2.188. Điểm nóng chảy 78 ° C (octahydrat,> 408 ° C đối với bari hydroxit nguyên chất). Chỉ số khúc xạ 1.471. Chất độc có nồng độ cao. Có tính ăn mòn mạnh. Để xác định cacbon đioxit trong không khí. Định lượng diệp lục. Tinh chế đường và dầu động thực vật.
Khối lượng phân tử của Ba (OH) 2 · 8H2O là 315,47, nó là một tinh thể đơn tà không màu, tỷ trọng tương đối là 2,18, nhiệt độ nóng chảy là 78 ° C và nhiệt độ sôi là 780 ° C. Nó trở thành bari hydroxit khan sau khi sưởi. Cả hai đều độc.
Hầu hết các chất kiềm đều không tan trong nước. Bari hydroxit là một trong những chất kiềm hòa tan trong nước. Các chất kiềm hòa tan trong nước là: liti hydroxit, natri hydroxit, kali hydroxit, rubidi hydroxit, xêzi hydroxit, bari hydroxit, stronti hydroxit, canxi hydroxit (hơi hòa tan, coi như hòa tan trong nước), nước amoniac (chất tan là khí amoniac) bari hydroxit rắn rất dễ gây mê sảng khi để trong không khí, và sau đó tạo thành bari cacbonat và nước có cacbon đioxit.
Ba (OH) 2 có tính kiềm mạnh, tính kiềm của nó mạnh nhất trong số các hiđroxit kim loại kiềm thổ, có thể làm dung dịch phenolphtalein chuyển sang màu đỏ và làm xanh quỳ tím.
Ba (OH) 2 có thể hấp thụ khí cacbonic từ không khí và chuyển nó thành bari cacbonat.
Ba (OH) 2 + CO2 == BaCO3 ↓ + H2O
Ba (OH) 2 có thể trung hòa với axit, trong đó nó sẽ tạo kết tủa với axit sunfuric:
Ba (OH) 2 + H2SO4 == BaSO4 ↓ + 2H2O
Mục đích chính là làm xà phòng đặc biệt và thuốc diệt côn trùng. Nó cũng được sử dụng để làm mềm nước cứng, tinh chế đường củ cải, tẩy cặn nồi hơi và bôi trơn thủy tinh. Nó cũng được sử dụng trong tổng hợp hữu cơ và điều chế muối bari.
Do tính kiềm mạnh của bari hydroxit, bari hydroxit có tác dụng ăn mòn da, giấy, v.v. Bari hydroxit không gây ô nhiễm môi trường nhưng có tính kiềm mạnh nên tránh tiếp xúc với động vật và thực vật. Bari hydroxit có hại cho sức khỏe. Người lao động tiếp xúc với các hợp chất bari trong thời gian dài có thể bị suy nhược, khó thở,…
Bari hydroxit dùng làm xúc tác tổng hợp nhựa phenol, phản ứng trùng ngưng dễ điều khiển, nhựa thu được có độ nhớt thấp, tốc độ đóng rắn nhanh, xúc tác dễ khử. Liều lượng tham chiếu là 1% đến 1,5% phenol. Nó cũng được sử dụng làm chất xúc tác cho chất kết dính phenol-fomanđehit biến tính bằng urê hòa tan trong nước, sản phẩm đóng rắn có màu vàng nhạt và muối bari hóa trị hai còn lại trong nhựa không ảnh hưởng đến tính chất điện môi và độ ổn định hóa học.
Bari hydroxit được sử dụng như một thuốc thử phân tích, và cũng được sử dụng để tách sunfat kết tủa và sản xuất muối bari.
Phương trình hóa học:
Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
SiO2 + Ba(OH)2 → BaSiO3 + H2O