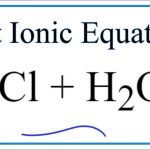Carbon dioxide (carbon dioxide), một loại hợp chất oxy carbon, công thức hóa học là CO2, trọng lượng công thức hóa học là 44.0095. Carbon dioxide không màu và không mùi ở nhiệt độ và áp suất bình thường hoặc không màu, không mùi và ở dạng nước dung dịch có vị hơi chua cũng là một khí nhà kính thông thường và nó cũng là một thành phần của không khí (0,03% -0,04% tổng thể tích của khí quyển.
Về tính chất vật lý, carbon dioxide có nhiệt độ nóng chảy -56,6 ° C (527kPa) và nhiệt độ sôi -78,5 ° C. Tỷ trọng cao hơn so với không khí (ở điều kiện tiêu chuẩn) và nó hòa tan trong nước .
Về tính chất hóa học, cacbon đioxit không hoạt động hóa học, có độ bền nhiệt cao (chỉ phân hủy 1,8% ở 2000 ° C), không thể cháy và thường không hỗ trợ quá trình cháy, là một oxit axit, tính chung của oxit axit. Vì nó phản ứng với nước để tạo ra axit cacbonic, nó là một anhiđrit của axit cacbonic.
Carbon dioxide nói chung có thể được tạo ra bằng đá vôi nung ở nhiệt độ cao hoặc bằng phản ứng của đá vôi và axit clohydric loãng. Nó chủ yếu được sử dụng để làm lạnh thực phẩm dễ hỏng (rắn), làm chất làm lạnh (lỏng), sản xuất nước giải khát có carbon (thể khí) và dung môi cho phản ứng đồng nhất (trạng thái siêu tới hạn).
Về độc tính của nó, các nghiên cứu đã chỉ ra rằng carbon dioxide nồng độ thấp không độc, và carbon dioxide nồng độ cao có thể gây ngộ độc cho động vật.
Hình dạng phân tử của CO2 là dạng thẳng và cấu trúc của nó từng được cho là: O = C = O. Tuy nhiên, độ dài liên kết carbon-oxy trong phân tử CO2 là 116pm, là giữa liên kết đôi carbon-oxy (độ dài liên kết là 124pm) và liên kết ba carbon-oxy (độ dài liên kết là 113pm), vì vậy carbon- liên kết oxy trong CO2 có một mức độ nhất định.
Các nhà khoa học hiện đại thường tin rằng nguyên tử cacbon trung tâm của phân tử CO2 thông qua sự lai hóa sp. Hai obitan lai hóa sp xen phủ với obitan 2p của hai nguyên tử oxy (chứa một điện tử) để tạo thành hai liên kết σ và p trên nguyên tử cacbon là vuông góc sau đó các obitan tạo thành hai liên kết π lớn với obitan p song song với hai nguyên tử oxi.
3HCl + 2CO2 → 2O2 + C2H3Cl3
CO2 + 3H2SO4 → CO2(SO4)3 + 3H2
CO2 là một oxit có tính axit, HCl là một chất có tính axit, hai chất này không thể phản xạ Nhưng HCl có thể tạo ra CO2, phương trình là:
2HCl + CaCO3 == CaCl2 + H2O + CO2 ↑
Cho hai khí đi qua một lượng nước cất thích hợp, vì tính axit mạnh hơn H2CO3 nên trong nước chỉ có HCl. HCl được tách ra khỏi CO2. Sau đó, dung dịch HCl được đun nóng cho bay hơi đến khô, cho khí đi qua đồng sunfat (CuSO4) để loại bỏ hơi nước thu được khí HCl.
Cho vào ống nghiệm một lượng nhỏ dung dịch A rồi tiếp tục thêm dung dịch B. Nếu lớp dưới không ngừng tăng lên thì B là CCl4, nếu lớp trên không ngừng tăng lên thì B là H2O, CCl4 không tan trong nước và có a tỷ trọng cao hơn nước.
Cacbon tetraclorua là chất lỏng không màu, trong và dễ chảy, đôi khi hơi vàng do lẫn tạp chất, có mùi thơm, dễ bay hơi. Mật độ (20 ° C) là 1,595 g / cm3, điểm nóng chảy là -22,8 ° C và điểm sôi là 76 đến 77 ° C.
Hơi của cacbon tetraclorua nặng hơn không khí khoảng 5 lần và sẽ không cháy, tính năng này thường được dùng để dập lửa, đặc biệt để dập lửa xăng, dầu hỏa và các loại dầu khác không thể trộn lẫn với nước, cũng như các thiết bị điện.
Một khi cacbon tetraclorua chuyển hóa thành hơi, nó chìm xuống phần dưới của không khí, đẩy hết không khí ra ngoài và ngọn lửa bị dập tắt một cách tự nhiên.