Silicon dioxide (Silic đioxit) có công thức hóa học SiO2, là một oxit có tính axit và hiđrat tương ứng là axit silicic (H2SiO3). SiO2 phổ biến nhất trong tự nhiên là thạch anh, cũng như trong các sinh vật khác nhau.
Silica là hợp chất quan trọng nhất của silic, chiếm khoảng 12% khối lượng của vỏ trái đất. Có hai dạng silica trong tự nhiên là dạng tinh thể và dạng vô định hình nên chúng được gọi chung là silica.
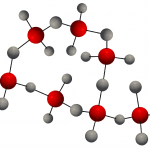
Tinh thể SiO2 có nhiều dạng tinh thể, đơn vị cấu tạo cơ bản của nó là một tứ diện, mỗi Si được bao bọc bởi 4 chữ O, Si ở tâm và chữ O ở bốn góc. Có 6 nguyên tử silic và 6 nguyên tử oxi trên vòng nhỏ nhất. Nhiều tứ diện trong số này được nối với O ở các góc trên cùng và mỗi O là chung của hai tứ diện, tức là mỗi O kết hợp với 2 Si.
Thực chất, tinh thể SiO2 là những tinh thể có cấu trúc mạng ba chiều được cấu tạo bởi Si và O theo tỷ lệ 1: 2. Do đó, SiO2 thường được sử dụng để biểu thị thành phần của silica. Tứ diện SiO4 không chỉ tồn tại trong tinh thể SiO2, mà còn tồn tại trong tất cả các loại quặng silicat, và là bộ khung cơ bản cấu thành thế giới silicat muôn màu.
SiO2 có các đặc tính của độ cứng cao, chịu nhiệt độ cao, chống va đập và cách điện. Nó có thể truyền ánh sáng nhìn thấy, cũng như ánh sáng đỏ và tia cực tím.
Silica là một oxit có tính axit và hyđrat cao nhất tương ứng là axit silicic (H2SiO3). Silica không hoạt động về mặt hóa học và không dễ dàng phản ứng với nước và hầu hết các axit. Thông thường nó chỉ có thể phản ứng với oxit bazơ để tạo thành muối. Axit flohydric (HF) và axit photphoric đặc (H3PO4) là những axit có thể phản ứng với chúng.
Phương trình hóa học của phản ứng của nó với axit flohidric để tạo ra silic florua là:
SiO2 + 4HF = 2H2O + SiF4
Thông thường nó chỉ có thể phản ứng với oxit bazơ để tạo thành muối. Ví dụ:
CaO + SiO2 → CaSiO3
Phản ứng với bazơ mạnh tạo thành muối. Ví dụ:
SiO2 + 2NaOH → Na2SiO3 + H2O
Khi có một nồng độ nhất định bột silica trong không khí, nó sẽ đi vào phổi qua đường hô hấp của con người và gây ra các bệnh về đường hô hấp như bệnh bụi phổi.
Cấu trúc mạng của 2 xác định nó có những tính chất vật lý và hóa học tuyệt vời, ngoài ra SiO2 được ứng dụng rộng rãi trong tự nhiên và được nhân loại sử dụng rộng rãi từ xưa đến nay.
Silica và các hợp chất khác được nấu chảy ở nhiệt độ cao và làm lạnh nhanh chóng để tạo ra thủy tinh. Nó cũng là thành phần chính của cát và thạch anh. Nó hiện là nguyên liệu chính trong các ứng dụng như chất bán dẫn và tấm pin mặt trời.
Loại thủy tinh đặc biệt chỉ chứa một thành phần duy nhất là silicon dioxide được gọi là thủy tinh thạch anh. Silic đioxit có thể được trộn với than chì hoặc kim loại hoạt động để tạo ra nguyên tố silic bằng phản ứng oxi hóa khử.
SiO2 được sử dụng làm chất chống đóng cục trong công nghiệp thực phẩm và là phụ gia thực phẩm. Silica bốc khói dạng keo, kết tủa hoặc sinh nhiệt là một chất phụ gia phổ biến trong sản xuất thực phẩm.