Amoniac công thức phân tử là NH3 là một chất khí không màu, có mùi hắc (mùi tiểu). Ở nhiệt độ và áp suất thường, 1 đơn vị thể tích nước có thể hòa tan gấp 700 lần thể tích amoniac. Amoniac rất quan trọng đối với các sinh vật trên trái đất, và nó là thành phần quan trọng của tất cả thực phẩm và phân bón. Amoniac cũng là thành phần trực tiếp hoặc gián tiếp của nhiều loại thuốc và sản phẩm tẩy rửa thương mại, và có các đặc tính nguy hiểm như ăn mòn.
Vì amoniac có nhiều mục đích sử dụng, nó đã trở thành một trong những hợp chất vô cơ có năng suất cao nhất trên thế giới, và khoảng 80% trong số đó được sử dụng để sản xuất phân bón. Năm 2006, sản lượng amoniac toàn cầu ước tính khoảng 146,5 triệu tấn, được sử dụng chủ yếu để sản xuất các sản phẩm tẩy rửa thương mại.
Điều chế muối amoni rắn: NH4Cl → HCl + NH3
Đun nóng hỗn hợp rắn gồm muối amoni và kiềm.
Nguyên tắc phản ứng: 2NH4Cl + Ca (OH) 2 = CaCl2 + 2NH3 ↑ + 2H2O
Thiết bị phản ứng: rắn + thiết bị khí nung nóng rắn. Gồm ống nghiệm, đèn cồn, giá đỡ bằng sắt (có kẹp sắt), v.v.
Thiết bị làm sạch (có thể bỏ qua): làm khô bằng vôi soda.
Dụng cụ thu: phương pháp thoát khí hướng xuống, phương pháp thử đầy đủ là đặt giấy thử quỳ đỏ ướt lên miệng ống nghiệm, giấy thử chuyển sang màu xanh lam; hoặc đưa đũa thủy tinh đã nhúng axit clohiđric đặc lên miệng ống nghiệm, có khói trắng được tạo ra.
Thiết bị thoát khí: Khi thu thường cắm bông gòn vào miệng vòi, có tác dụng làm giảm tốc độ đối lưu của NH3 và không khí, đồng thời thu được NH3 tinh khiết.
Chú ý: Không dùng NH4NO3 để phản ứng với Ca (OH) 2 tạo amoniac. Amoni nitrat dễ phát nổ khi va chạm và đun nóng, sản phẩm liên quan đến nhiệt độ, có thể tạo ra NH3, N2, N2O và NO.
Đối với dung dịch NH3 làm trong phòng thí nghiệm, không được dùng NaOH và KOH thay thế cho Ca (OH) 2. Vì NaOH và KOH là bazơ mạnh, chúng hút ẩm (dễ chảy) và có xu hướng kết tụ, và chúng không dễ trộn với muối amoni khi tiếp xúc và phản ứng hoàn toàn. Ngoài ra, KOH và NaOH có tính ăn mòn cao, khi đun nóng có tác dụng ăn mòn các dụng cụ thủy tinh nên không dùng NaOH và KOH thay thế cho Ca (OH) 2 tạo NH3.
Dùng ống nghiệm thu amoniac để chặn bông. Do đường kính của các hạt phân tử NH3 nhỏ nên dễ dàng đối lưu với không khí, mục đích của nút bông là ngăn cản sự đối lưu của NH3 với không khí, đảm bảo độ tinh khiết của quá trình thu gom, giảm ô nhiễm của NH3 lên không trung.
NH3 làm trong phòng thí nghiệm dùng vôi tôi xút thay cho H2SO4 đặc và CaCl2 đặc để khử hơi nước. Vì H2SO4 đặc phản ứng với NH3 tạo ra (NH4) 2SO4. NH3 phản ứng với CaCl2 tạo ra CaCl2 · 8NH3 (octammine canxi clorua).
CaCl2 + 8NH3 = CaCl2 · 8NH3
Cân bằng sau đây tồn tại trong nước amoniac đậm đặc:
NH3 + H2O⇌ NH3 · H2O⇌NH4 + + OH-, thêm các chất kiềm rắn (như CaO, NaOH, vôi tôi xút, v.v.), tiêu thụ nước và tăng lượng OH-, chuyển cân bằng về giữa, và phản ứng tỏa nhiệt, Thúc đẩy sự phân hủy NH3 · H2O.
Có thể dùng axit clohydric đậm đặc để thử khí amoniac.
NH3 (g) + HCl (g) → NH4Cl (s)
Vì amoniac có tính kiềm yếu nên khi thử bằng giấy quỳ đỏ sẽ có màu xanh lam. Vì amoniac là chất khí nên trước hết phải ngâm giấy thử.
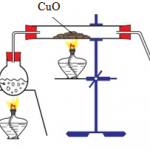
Cho khí NH3 dư qua CuO nung nóng ta thu được phản ứng sau:
3CuO + 2NH3 = 3Cu + 3H2O + N2↑