Etanol (etanol) là một hợp chất hữu cơ có cấu trúc ngắn gọn là CH3CH2OH hoặc C2H5OH và công thức phân tử là C2H6O, thường được gọi là rượu.
Ethanol là một chất lỏng không màu và trong suốt dễ bay hơi ở nhiệt độ và áp suất bình thường, có độc tính thấp, chất lỏng nguyên chất không thể uống trực tiếp. Dung dịch nước etanol có mùi rượu, hơi hắc và ngọt.
Ethanol dễ cháy và hơi của nó có thể tạo thành hỗn hợp nổ với không khí. Ethanol có thể trộn lẫn với nước theo bất kỳ tỷ lệ nào và có thể trộn lẫn với cloroform, ete, metanol, axeton và hầu hết các dung môi hữu cơ khác.
Etanol có thể được sử dụng để sản xuất axit axetic, đồ uống, hương liệu, thuốc nhuộm, nhiên liệu, … Etanol với phần thể tích từ 70% đến 75% thường được sử dụng như một chất khử trùng trong điều trị y tế.
Ethanol được sử dụng rộng rãi trong công nghiệp hóa chất, y tế và sức khỏe, công nghiệp thực phẩm, sản xuất nông nghiệp và các lĩnh vực khác.
Etanol là rượu đơn chức no có nhóm hydroxyl. Nó có thể được coi là sản phẩm trong đó nguyên tử hydro trong phân tử etan được thay thế bằng nhóm hydroxyl hoặc sản phẩm trong đó nguyên tử hydro trong phân tử nước được thay thế bằng nhóm etylic.
Phân tử etanol là một phân tử phân cực bao gồm các nguyên tử C, H và O. Các nguyên tử C và O đều được liên kết bằng các obitan lai hóa sp³.
Các tính chất vật lý của etanol chủ yếu liên quan đến các tính chất của rượu mạch thẳng cacbon thấp. Các nhóm hydroxyl trong phân tử có thể hình thành liên kết hydro, do đó, etanol dễ tan và có thể nhanh chóng hút ẩm từ không khí.
Sự hiện diện của liên kết hydro giữa các phân tử cũng làm cho nhiệt độ sôi của etanol cao hơn so với ankan có khối lượng phân tử tương tự.
Sự phân cực của nhóm hydroxyl trong phân tử etanol làm cho nhiều hợp chất ion hòa tan trong etanol, chẳng hạn như natri hydroxit, kali hydroxit, magie clorua, canxi clorua, amoni clorua, amoni bromua và natri bromua, v.v …; nhưng natri clorua và kali clorua ít tan trong etanol.
Nhóm hydrocacbon không phân cực cho phép etanol hòa tan một số chất không phân cực, chẳng hạn như hầu hết các loại tinh dầu và nhiều chất điều vị, chất tạo màu và thuốc thử dược phẩm.
Etanol có tính axit yếu (nói một cách chính xác, nó không có tính axit và không thể làm đổi màu chất chỉ thị axit-bazơ), do có chứa các liên kết oxy-hydro phân cực nên nó sẽ tạo ra các anion alkoxy và proton trong quá trình ion hóa.
Phương trình ion hóa là:
CH3CH2OH = CH3CH2O + H2
Các kim loại hoạt động như kali, canxi và natri có thể thay thế hydro trong nhóm hydroxyl của etanol để tạo thành alkoxit và hydro, nhưng nó không phản ứng dữ dội như phản ứng với nước.
Alkoxit thủy phân nhanh chóng khi tiếp xúc với nước để tạo thành rượu và kiềm, và dung dịch nước của natri ethoxit có tính kiềm mạnh. Công thức phản ứng hóa học là:
2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
CH3CH2ONA + H2O = CH3CH2OH + NAOH
Phản ứng cháy của etanol là phản ứng oxi hóa theo nghĩa rộng. Khi đốt cháy hoàn toàn etanol thì phát ra ngọn lửa màu xanh nhạt, sinh ra khí cacbonic và hơi nước, toả nhiều nhiệt.
Công thức phản ứng hóa học là:
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
Khi đốt cháy không hoàn toàn etanol, cacbon monoxit được tạo thành, ngọn lửa màu vàng và tỏa nhiệt.
Công thức phản ứng hóa học là:
2 CH3COCOOH + 5O2 → 2CO2+ 2CO + 6H2O
Trong hóa học hữu cơ, phản ứng oxy hóa đề cập cụ thể đến phản ứng thêm oxy hoặc loại bỏ hydro. Ethanol có thể trải qua phản ứng dehydro hóa và bị oxy hóa thành acetaldehyde. Công thức phản ứng hóa học là:
2CH3CH2OH + O2 -Cu hoặc Ag → 2CH3CHO + 2 H2O
Các phương trình hóa học:
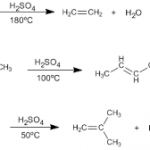
C2H5OH → C2H4 + H2O
C2H5OH + O2 → CH3COOH + H2O