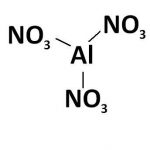
Nhôm hydroxit công thức hóa học Al (OH) 3. Nó là một loại kiềm, vì tính axit của nó, nó còn thường được gọi là “aluminat” (H3AlO3 “hoặc” HAlO2 · H2O), nhưng phản ứng thực tế với kiềm là tetrahydroxyaluminat.
Nhôm hydroxit không hòa tan trong nước và rượu, nhưng có thể hòa tan trong axit và kiềm mạnh, đồng thời phản ứng với chúng.
Trong phòng thí nghiệm người ta thường dùng muối nhôm và kiềm để phản ứng tạo ra hiđroxit nhôm, nhưng vì nhôm hiđroxit sẽ phản ứng với bazơ mạnh nhưng không dễ phản ứng với bazơ yếu, nếu dùng bazơ mạnh để điều chế nhôm hiđroxit thì lượng nhôm hydroxit thêm vào không dễ kiểm soát.
Do đó, người ta thường không điều chế bằng cách sử dụng bazơ mạnh như natri hydroxit và kali hydroxit, mà nước amoniac được sử dụng để phản ứng với muối nhôm.
Công thức phản ứng:
Al3 + + 3NH3.H2O → Al (OH) 3 ↓ + 3NH4 +
Trong phòng thí nghiệm, nhôm hiđroxit cũng có thể được điều chế bằng phản ứng của mantozơ và axit, tương tự như kiềm, nhôm hiđroxit cũng dễ phản ứng với axit mạnh nhưng không dễ phản ứng với axit yếu nên người ta thường điều chế bằng phản ứng với axit yếu như axit cacbonic:
[Al (OH) 4] – + H + → H2O + Al (OH) 3
Nhôm hydroxit là một chất lưỡng tính, có thể phản ứng với axit và kiềm.
Với axit: Nhôm hiđroxit phản ứng với axit mạnh tạo thành muối nhôm.Công thức phản ứng chung là:
Al (OH) 3 (s) + 3H + (aq) → Al3 + (aq) + 3H2O (l)
Với kiềm: Nhôm hydroxit phản ứng với kiềm mạnh tạo ra tetrahydroxyaluminat —— [Al (OH) 4] -. Công thức phản ứng tổng quát là:
Al (OH) 3 (s) + OH− (aq) → [Al (OH) 4] – (aq)
Phương trình hóa học:
2Al + 3H2SO4 (loãng) = Al2 (SO4) 3 + 3H2 ↑
2Al + 2NaOH + 6H2O = 2Na [Al (OH) 4] + 3H2 ↑
Al2 (SO4) 3 + 6Na [Al (OH) 4] + 12H2O = 8Al (OH) 3 ↓ + 3Na2SO4
Hoặc Al2 (SO4) 3 + 6NH3.H2O = 2Al (OH) 3 ↓ + 3 (NH4) 2SO4
Phương trình ion:
2Al + 6H + = 2Al3 ++ 3H2 ↑
2Al + 2OH- + 6H2O = 2 [Al (OH) 4] – + 3H2 ↑
Al3 ++ 3 [Al (OH) 4] – + 6H2O = 4Al (OH) 3 ↓
Hoặc Al3 ++ 3NH3 · H2O = Al (OH) 3 ↓ + 3NH4 +
Al (OH) 3 là một hiđroxit lưỡng tính. Nó có thể phản ứng với axit mạnh và bazơ mạnh ở nhiệt độ thường:
Al (OH) 3 + 3HCl = AlCl3 + 3H2O
Al (OH) 3 + 3H + = Al3 ++ 3H2O
Al (OH) 3 + NaOH = Na [Al (OH) 4]
Al (OH) 3 + OH – = [Al (OH) 4] –
Al (OH) 3 dễ bị phân hủy thành Al2O3 khi đun nóng:
2Al (OH) 3 = Al2O3 + 3H2O (quy tắc: kiềm không tan sẽ bị phân hủy khi đun nóng)
Điều chế Al (OH) 3:
– Muối nhôm tan phản ứng với amoniac để điều chế Al (OH) 3:
AlCl3 + 3NH3 · H2O = Al (OH) 3 ↓ + 3NH4Cl Al2 (SO4) 3 + 6NH3 · H2O = 2Al (OH) 3 ↓ + 3 (NH4) 2SO4 (Al3 ++ 3NH3 · H2O = Al (OH) 3 ↓ + 3NH4 +)
Vì bazơ mạnh (như NaOH) dễ phản ứng với Al (OH) 3 nên phòng thí nghiệm không dùng bazơ mạnh để điều chế Al (OH) 3 mà dùng amoniac
– Natri tetrahydroxy aluminat phản ứng với lượng dư cacbon đioxit:
Na [Al (OH) 4] + CO2 (hết) = NaHCO3 + Al (OH) 3 ↓
Khí cacbonic dư không phản ứng với nhôm hydroxit để đảm bảo rằng [Al (OH) 4] -tất cả tạo ra nhôm hydroxit.
NH3 + H2O = NH2 + H3O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
NH4Cl + Al(OH)3 = AlCl3 + NH3 + H2O
2Al(OH)3 + 3CO2 → 3H2O + Al2(CO3)3
Cái gọi là nhôm hydroxit thực sự đề cập đến hyđrat của nhôm oxit. Ví dụ, kết tủa keo trắng thu được khi thêm amoniac hoặc kiềm yếu vào dung dịch muối nhôm có hàm lượng nước thay đổi và thành phần không đồng đều, và được gọi chung là alumin ngậm nước.
Chỉ bằng cách cho CO2 đi qua trong dung dịch aluminat (có chứa ion Al (OH) 4) thì mới thu được nhôm hiđroxit thực sự.