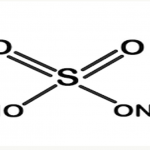
Natri bisunfat (công thức hóa học NaHSO4), còn được gọi là natri axit sunfat, là chất được hình thành do phản ứng giữa natri clorua (muối) và axit sunfuric ở nhiệt độ cao.
Natri bisunfat được sử dụng rộng rãi trong chất tẩy rửa gia dụng, chiết xuất bạc kim loại, làm giảm độ kiềm của nước bể bơi, v.v., làm chất bảo quản trong phân tích mẫu đất và nước trong phòng thí nghiệm và điều chế axit sulfuric trong phòng thí nghiệm .
Tính chất vật lý
Natri bisunfat là tinh thể không màu, không mùi. Natri bisunfat được tạo thành khi đun nóng. Nó được phân hủy thành natri sunfat và axit sunfuric tự do bởi etanol. Hòa tan trong khoảng 0,8 phần nước, dung dịch nước của nó có tính axit mạnh và giá trị pH của dung dịch 0,1mol / L là 1,4. Tỷ trọng tương đối (d18,54) 2,103, (d12) 2,435 (khan). Điểm nóng chảy là 58,5 ° C và điểm sôi là khoảng 315 ° C (khan).
Natri bisunfat dùng để xác định brom, iot, đồng và titan đioxit và phân tích khoáng chất.
1. Tính chất của muối: muối axit của axit mạnh
2. Tính axit và tính kiềm: dung dịch nước có tính axit. Ion hóa không hoàn toàn, tạo ra dung dịch axit mạnh: NaHSO4 = thuận nghịch = Na + + H + + SO42-
Do đó, nó có thể phản ứng với bazơ. NaHSO4 + NaOH == Na2SO4 + H2O
3. Nó có thể trải qua phản ứng tạo phản ứng với muối axit yếu: NaHSO4 + NaHSO3 == Na2SO4 + SO2 ↑ + H2O
NaHSO4 + NaHCO3 == Na2SO4 + CO2 ↑ + H2O
Phương trình ion: H ++ SO42- + HSO3 – == SO2 ↑ + H2O + SO42-
H ++ SO42- + HCO3 – == CO2 ↑ + H2O + SO42-
4. Phản ứng với BaCl2 và Ba (OH) 2: NaHSO4 + BaCl2 == NaCl + HCl + BaSO4 ↓
NaHSO4 + Ba (OH) 2 == NaOH + H2O + BaSO4 ↓
Liên quan đến phương trình ion: SO42- + Ba2 + == BaSO4 ↓
H ++ SO42- + Ba2 + + OH – == BaSO4 ↓ + H2O
Nếu Ba (OH) 2 nhỏ, phương trình được biểu diễn là: 2H ++ SO4 2- + Ba2 ++ 2OH – == BaSO4 ↓ + 2H2O
Natri bisunfat có thể thu được bằng hai cách. Natri hydro sunfat và nước có thể thu được bằng cách trộn lượng natri hydroxit và axit sunfuric bằng nhau.
NaOH + H2SO4 → NaHSO4 + H2O Natri clorua (muối ăn) và axit sunfuric có thể phản ứng ở nhiệt độ cao tạo ra natri hiđro sunfat và khí hiđro clorua. NaCl + H2SO4 → NaHSO4 + HCl Sử dụng chất tẩy rửa gia dụng (dung dịch 45%), chiết xuất bạc kim loại; giảm độ kiềm của nước bể bơi; thức ăn cho vật nuôi.
Natri bisunfat gây kích ứng và ăn mòn mạnh đối với mắt, da, màng nhầy và đường hô hấp trên.
Nguy cơ cháy nổ: Sản phẩm này không bắt lửa, ăn mòn và có tính kích ứng cao, có thể gây bỏng cho cơ thể con người.
Các tính chất vật lý và hóa học
Thành phần chính: Hàm lượng: loại thuốc thử 98,5% -100%; loại công nghiệp ≥95%; loại công nghiệp ≥90%.
Hình thức và Tính chất: Tinh thể hoặc hạt màu trắng, không mùi.
pH: 1 ~ 2 (5% natri bisunfat)
Điểm nóng chảy (℃):> 315 (phân hủy)
Điểm sôi (℃): Không có thông tin
Mật độ tương đối (nước = 1): 2.435 (13 ℃)
Tỷ trọng hơi tương đối (không khí = 1): Không có thông tin
Áp suất hơi bão hòa (kPa): Không có thông tin
Nhiệt đốt cháy (kJ / mol): vô nghĩa
Nhiệt độ tới hạn (° C): vô nghĩa
Áp suất tới hạn (MPa): vô nghĩa
Hệ số phân chia lôgarit octanol / nước: không có sẵn dữ liệu
Điểm chớp cháy (℃): vô nghĩa
Nhiệt độ bốc cháy (℃): vô nghĩa
Giới hạn trên của vụ nổ% (V / V): vô nghĩa
Giới hạn nổ dưới% (V / V): vô nghĩa
Tính tan: tan trong nước, không tan trong amoniac lỏng.
Công dụng chính: được sử dụng làm chất trợ dung, chất trợ in và nhuộm, thuốc thử phân tích, chất cải tạo đất và chất khử trùng, và được sử dụng để sản xuất phèn sunfat và natri, v.v.
Ví dụ về phương trình hóa học: NaHSO4 + NaOH → Na2SO4 + H2O
Phương trình ion rút gọn: HSO4- + OH- → SO42- + H2O