Cân bằng phương trình
Cl2 + C6H5CH3 → HCl + C6H5CH2Cl
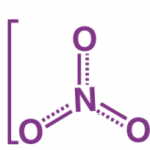
2KMnO4 + C6H5CH3 → H2O + KOH + 2MnO2 + C6H5COOK
Tìm hiểu về KMnO4
Kali Permanganat là gì?
Kali Permanganat (KMnO4) là một hợp chất hóa học vô cơ. Nó còn được gọi là tinh thể Condy’s hoặc pemanganat của muối kali.
Nhà hóa học người Đức gốc Hà Lan Johann Rudolf Glauber là người đầu tiên phát hiện ra việc sản xuất KMnO4 vào năm 1659. Hợp chất này tan trong nước và bao gồm hai ion: ion Permanganat và ion kali. Nó là một chất rắn không mùi màu tím sẫm ở trạng thái vật lý.
Khi hòa tan tinh thể thuốc tím vào nước, dung dịch tạo thành có màu tím. Nó được coi là một chất oxy hóa mạnh và không tạo ra chất độc hại cho sản phẩm. Nó thường được điều chế từ các khoáng chất khác như oxit mangan.
Điều chế kali pemanganat – KMnO4
Kali pemanganat được điều chế thương mại bằng cách trộn dung dịch KOH và oxit mangan dạng bột, với các chất oxy hóa như kali clorat. Hỗn hợp được đun sôi cho bay hơi và phần cặn được đun nóng trong chảo sắt cho đến khi có được độ sệt.
6KOH + 3MnO2 + 6KClO3 → 3K2MnO4 + 6KCl + 3H2O
Kali manganate (màu xanh lá cây) được tạo thành được đun sôi với một lượng lớn nước và dòng điện của clo, CO2 và không khí bị ozon hóa được truyền vào chất lỏng cho đến khi chuyển hóa thành pemanganat. MnO2 được tạo thành được loại bỏ liên tục để ngăn nó phá vỡ pemanganat.
6K2MnO4 + 3Cl2 → 6KMnO4 (Kali pemanganat) + 6KCl
Dung dịch KMnO4 được tách ra khỏi kết tủa MnO2 đậm đặc và kết tinh. Các tinh thể được ly tâm và làm khô.
Tính chất vật lý của Kali Permanganat – KMnO4
Nó là chất rắn kết tinh không mùi, có màu tím đến đỏ tươi.
Nó có thể hòa tan trong nước, axeton, axit axetic, metanol và pyridin.
Nó được hòa tan trong etanol và các dung môi hữu cơ.
Kali pemanganat xuất hiện ở dạng lăng kính đơn tà, gần như không trong suốt với ánh kim loại màu xanh lam.
Nó không mùi. Dung dịch nước có vị ngọt làm se. Nó hòa tan trong nước và hòa tan nhiều hơn trong nước sôi.
Tính chất hóa học của kali pemanganat
Kali pemanganat là một chất oxy hóa rất mạnh và do đó có thể được sử dụng như một chất oxy hóa trong một loạt các phản ứng hóa học.
Có thể thấy khả năng oxi hóa của thuốc tím khi thực hiện phản ứng oxi hóa khử với nó, trong đó dung dịch màu tím sẫm chuyển thành không màu và sau đó chuyển thành dung dịch màu nâu.
Phản ứng trên có thể thực hiện trong môi trường axit hoặc môi trường bazơ.
KMnO4 Kali pemanganat
Tên hợp chất Kali manganate (VII)
Khối lượng phân tử / Khối lượng mol của Kali pemanganat 158,034 g / mol
Mật độ của Kali pemanganat 2,703 g / cm³
Nhiệt độ bảo quản Kali pemanganat Nhiệt độ phòng
Điểm sôi của kali pemanganat 100oC
Điểm nóng chảy của kali pemanganat 240 ° C
Trạng thái oxy hóa +7
Phản ứng của Kali Permanganat (KMnO4)
1. Sự phân hủy do nhiệt:
Khi đun nóng kali pemanganat rắn, nó sẽ bị phân hủy. Phản ứng như sau:
2KMnO4 → K2MnO4 + MnO2 (s) + O2
2. Phản ứng với axit:
Khi pemanganat phản ứng với axit clohiđric đặc, nó tạo ra clo. Trong một dung dịch trung tính, pemanganat bị khử bởi ba điện tử để tạo ra mangan đioxit, ở đó trạng thái oxi hóa của mangan là +4. Kali pemanganat khử tự nhiên trong dung dịch kiềm và chuyển thành K2MnO4 màu xanh lục.
3. Tác dụng của Alkalies
Khi đun nóng với kiềm, kali pemanganat biến đổi thành manganat và khí oxy được hình thành.
4KMnO4 + 4KOH → 4K2MnO4 + 2H2O + O2
4. Tính chất oxy hóa
KMnO4 đóng vai trò là chất oxi hóa rất mạnh trong môi trường axit, trung tính và kiềm. Các phương trình biểu thị quá trình oxy hóa trong các môi trường này là
Trong môi trường axit
2KMnO4 + H2SO4 → K2SO4 + 2MnSO4 + 3H2O + 5 [O] MnO4– + 8H + + 5e– → Mn2 + + 4H2O
Trong môi trường trung tính hoặc kiềm
2KMnO4 + H2O → 2KOH + 2MnO2 + 3 [O] MnO4– + 2H2O + 3e– → MnO2 + 4OH–