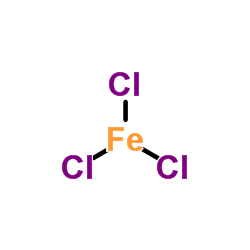
Cân bằng phương trình
2HI + 2FeCl3 → 2FeCl2 + 2HCl + I2
2FeCl3 + 2HBr = 2FeCl2 + Br2 + 2HCl
Tìm hiểu về FeCl3
Ferric Chloride là gì?
Ferric Clorua là một tinh thể màu tối với trạng thái oxy hóa của sắt là +3. Nó còn được gọi là Sắt (III) clorua hoặc Molysite. Sắt (III) clorua là hợp chất vô cơ có công thức (FeCl3). Còn được gọi là clorua sắt, nó là một hợp chất phổ biến của sắt ở trạng thái ôxy hóa +3. Hợp chất khan là chất rắn kết tinh có nhiệt độ nóng chảy là 307,6 ° C. Màu sắc phụ thuộc vào góc nhìn: bởi ánh sáng phản xạ, các tinh thể có màu xanh lục đậm, nhưng do ánh sáng truyền qua chúng có màu đỏ tím.
Nó là một thực thể phối hợp sắt có chức năng như một chất làm se và axit Lewis. Công thức hóa học của Ferric Clorua là FeCl3.
Dung dịch molysit không màu đến nâu nhạt và có mùi axit clohydric (HCl) thoang thoảng. Nó ăn mòn hầu hết các kim loại và mô. Nó không cháy và được sử dụng rộng rãi trong lọc nước và xử lý nước thải.
Ở dạng khan, nó dễ bị mê sảng. Ngoài ra, quá trình thủy phân một phần diễn ra khi nó hút nước từ không khí và giải phóng hydro clorua (HCl) tạo thành sương mù trong không khí ẩm. Nó là một axit Lewis mạnh.
Tính chất của Clorua sắt – FeCl3
Clorua sắt FeCl3
Khối lượng phân tử của Ferric clorua 162,204 g / mol (khan)
Mật độ của Clorua sắt 2,90 g / cm3 (khan)
Điểm nóng chảy của clorua sắt 307,6 ° C
Điểm sôi của clorua sắt 316 ° C
Cấu trúc của Ferric Clorua (FeCl3)
Cấu trúc của Ferric Clorua
Cấu trúc của Ferric Clorua
Công dụng của Ferric Clorua (FeCl3)
Ferric Clorua được sử dụng trong tổng hợp hữu cơ như một chất xúc tác.
Nó được sử dụng để điều trị cắt xén móng vuốt động vật, đặc biệt là khi cắt xén quá nhiều dẫn đến chảy máu.
Nó được sử dụng làm thuốc thử làm khô trong một số phản ứng ở dạng khan.
Nó có ứng dụng rộng rãi trong các hệ thống lưu trữ năng lượng.
Điều chế clorua sắt
Sắt (III) clorua khan có thể được điều chế bằng cách cho sắt kim loại phản ứng với điclorua. Phương trình hóa học cho phản ứng này được cung cấp dưới đây.
2Fe + 3Cl2 → 2FeCl3
Chuẩn bị dung dịch clorua sắt
1. Hòa tan quặng sắt trong HCl (axit clohydric)
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
2. Bằng cách oxi hóa sắt (II) clorua bằng clo (Cl)
2FeCl2 + Cl2 → 2FeCl3
3. Bằng cách oxi hóa sắt (II) clorua bằng oxi
4FeCl2 + O2 + 4HCl → 4FeCl3 + 2H2O
Thử nghiệm clorua sắt
Thử nghiệm này được tiến hành để xác định sự có mặt hay không có phenol trong một mẫu nhất định. Các hợp chất như enol, axit hydroxamic, axit sulfinic và oxim cho kết quả tích cực. Số lượng phenol trong mẫu có thể được đo bằng xét nghiệm Folin-Ciocalteau.
Bước 1: Hòa tan mẫu vào nước cộng với etanol.
Bước 2: Thêm từng giọt dung dịch clorua sắt (FeCl3) loãng.
Bước 3: Nếu mẫu chuyển sang màu đỏ, xanh lục, tím hoặc xanh lam thì điều đó cho thấy sự hiện diện của phenol.
Bước 4: Trong trường hợp mẫu không tan trong nước, nó có thể được hòa tan trong diclometan (CH2Cl2) với một lượng nhỏ pyridin (C5H5N).