Cân bằng phản ứng
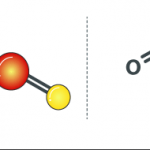
2C + SiO2 = 2CO + Si
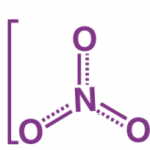
H2O + 2KOH + Si → H2 + K2SiO3
Tìm hiểu về SiO2
Silicon Dioxide là gì?
SiO2 là một oxit của silic với một tên hóa Silicon Dioxide. Nó cũng được gọi là silica hoặc Kalii bromidum hoặc oxit silicic hoặc axit silixic. Nó được tìm thấy rộng rãi trong tự nhiên như thạch anh.
Nó thu được dưới dạng trong suốt đối với màu xám, ở dạng bột tinh thể hoặc vô định hình của nó. Đó là không mùi và hợp chất vô vị.
Thuộc tính của Silicon Dioxide – SiO2
SiO2 Silicon Dioxide
trọng lượng phân tử SiO2 60,08 g / mol
Mật độ của Silicon Dioxide 2,648 g / cm3
Melting điểm của Silicon Dioxide 1.713 ° C
Sôi điểm của Silicon Dioxide 2.950 ° C
Silicon Dioxide Structure – SiO2
cấu trúc Dioxide silicon
SiO2Uses (Silicon Dioxide)
Silicon Dioxide được sử dụng trong ngành xây dựng để sản bê tông.
Ở dạng tinh thể của nó được sử dụng trong thủy lực cắt phá.
Được sử dụng trong sản xuất thủy tinh.
Sử dụng như một thuốc an thần.
Được sử dụng trong việc sản xuất các sản phẩm silicon nguyên tố.
Dùng làm chất chống đóng cứng trong thực phẩm bột như các loại gia vị.
Được sử dụng như một tác nhân xử phạt trong nước trái cây, bia và rượu vang.
Sử dụng thuốc dược phẩm.
Được sử dụng trong kem đánh răng để loại bỏ mảng bám răng.
Sản xuất Silicon Dioxide
silica vô định hình hoặc silica kết tủa thu được bằng các axit hóa các giải pháp natri silicat. Silica gel được rửa và khử nước để sản phẩm không màu silica microporous. Phản ứng liên quan đến một trisilicate cùng với axit sulfuric được đưa ra dưới đây:
Na2Si3O7 + H2SO4 → 3SiO2 + Na2SO4 + H2O
Phản ứng Dioxide silicon
Silica được chuyển đổi sang silicon bằng cách giảm với cacbon.
Flo khi phản ứng với silicon dioxide nó tạo ra SiF4 và O2.
Silicon tạo ra phản ứng dioxide với axít flohiđric để tạo ra axít hexafluorosilicic (H2SiF6).
SiO2 + 6HF → H2SiF6 + 2H2O
Trong silicon dioxide mỗi nguyên tử Si được bao quanh bởi 4 nguyên tử oxy và mỗi nguyên tử oxy được liên kết với 2 nguyên tử silicon.
Mối nguy hiểm sức khỏe
Silica khi ăn uống là không độc hại. Theo một nghiên cứu được tiến hành trong năm 2008, phát hiện ra rằng nồng độ của silica trong nước cao hơn, nguy cơ mất trí nhớ giảm. Do đó, liều được tăng lên đến 10 mg / ngày của silica trong nước uống như nguy cơ mất trí nhớ giảm. Khi mịn chia bụi silica tinh được hít vào, nó có thể dẫn đến viêm phế quản, ung thư phổi, hoặc bụi phổi silic, do chỗ bụi trong phổi. Khi các hạt silica tốt được hít vào với số lượng đủ lớn, nó làm tăng nguy cơ viêm khớp dạng thấp và lupus.
Câu hỏi thường gặp – Câu Hỏi Thường Gặp
những ứng dụng của silic dioxide là gì?
Khoảng 95 phần trăm của việc sử dụng công nghiệp của silic dioxide (cát) tồn tại trong ngành công nghiệp xây dựng, ví dụ phục vụ sản xuất bê tông (Portland bê tông xi măng). Silica, dưới hình thức của cát, được sử dụng như là thành phần quan trọng để sản xuất của các thành phần kim loại trong kỹ thuật và các ứng dụng khác của đúc cát. Các điểm nóng chảy tương đối cao silica cho phép việc sử dụng nó trong các ứng dụng này.
Làm thế nào là silicon dioxide được sản xuất?
Chủ yếu, silicon dioxide thu được thông qua các hoạt động khai thác khoáng sản bao gồm khai thác cát, và thanh lọc thạch anh. Thạch anh là phù hợp cho nhiều mục đích, trong khi xử lý hóa học là cần thiết để làm cho một phù hợp hơn sản phẩm (ví dụ phản ứng nhiều hơn hoặc hạt mịn) tinh khiết hay không. Silica fume có nguồn gốc từ quá trình nóng như chế biến ferrosilicon như một sản phẩm phụ của.
Là silicon dioxide độc hại?
Khi uống tiêu thụ, silica thực chất là không độc hại. Tuy nhiên, hít mịn chia bụi tinh thể silic có thể góp phần bụi phổi silic, viêm phế quản, hoặc ung thư phổi, như bụi bị mắc kẹt trong phổi và không ngừng kích thích các mô, giảm dung tích phổi.
chức năng của silicon dioxide là gì?
Silicon dioxide cũng được thêm vào nhiều loại thực phẩm và bổ sung. Là một phụ gia thực phẩm, nó đóng vai trò như một đại lý anticaking để tránh vón cục. Trong bổ sung, nó được sử dụng để ngăn chặn các thành phần bột khác nhau từ gắn bó với nhau.
Là SiO2 thẳng hoặc tứ diện?
SiO2 có hình dạng tuyến tính với hai oxy kết nối với Si bởi liên kết đôi. Không có cặp duy nhất trên Si. Đây sẽ là một ví dụ về lai sp. Ở dạng polymer SiO2 là tứ diện.