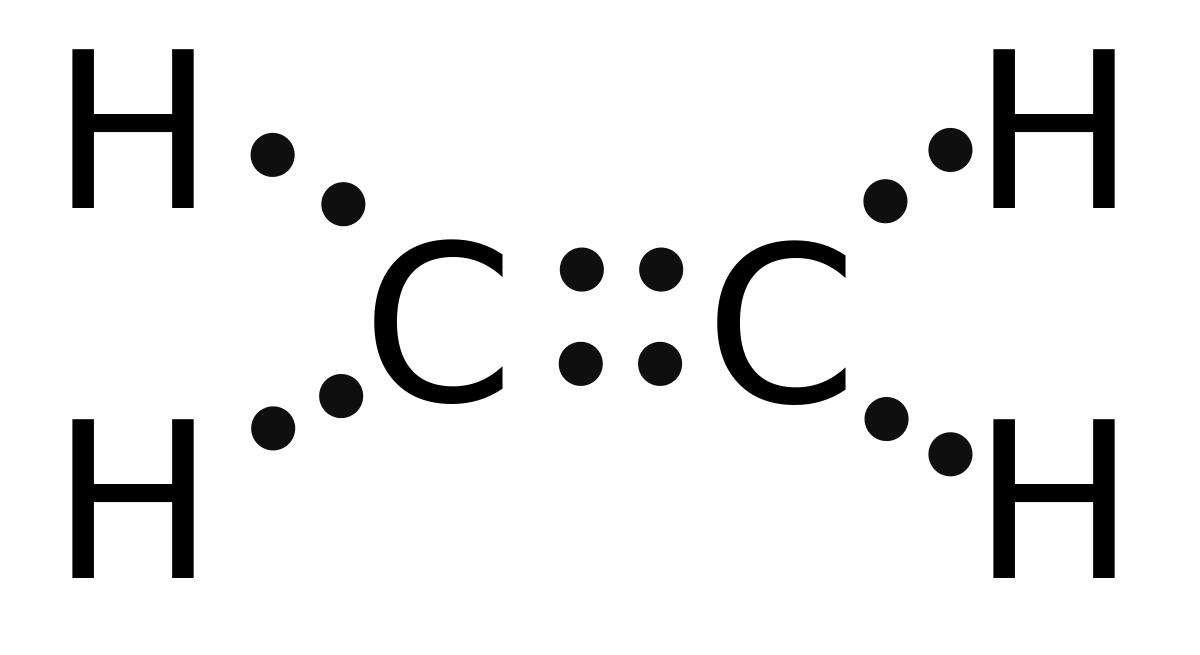
Cân bằng phương trình
3C2H4 + 4H2O + 2KMnO4 → 2KOH + 2MnO2 + 3C2H4(OH)2
C2H4 + HBr → C2H5Br
Tìm hiểu về C2H4
Ethylene là gì?
Etylen là một hợp chất hữu cơ không no có công thức hóa học là C2H4. Nó có một liên kết đôi và là thành viên đơn giản nhất của nhóm hydrocacbon anken.
C2H4 là một anken đơn giản nhất có tên hóa học là Etylen. Nó còn được gọi là Ethene hoặc Polyethylene hoặc Etileno. Nó được sử dụng rộng rãi như một loại hormone thực vật, chất làm lạnh và phụ gia thực phẩm.
Etylen là một chất khí không màu, có mùi và vị ngọt. Nó dễ cháy và nhẹ hơn khi so sánh với không khí. Khi tiếp xúc với nhiệt hoặc lửa trong thời gian dài, các thùng chứa có thể phát nổ.
Tính chất của Etylen – C2H4
C2H4 Etylen
Khối lượng phân tử của C2H4 28,054 g / mol
Mật độ của Ethylene 1,178 kg / m3
Điểm sôi của Ethylene -103,7 ° C
Điểm nóng chảy của Ethylene -169,2 ° C
Sản xuất Ethylene
Trong năm 2013 Etileno được sản xuất bởi khoảng 117 công ty từ 32 quốc gia.
Công nghiệp hóa dầu – Một phương pháp chủ yếu để sản xuất ethylene là bằng phương pháp crackinh hơi nước. Các hydrocacbon cùng với hơi nước được đốt nóng đến nhiệt độ từ 750–950 ° C. Nó chuyển đổi các hydrocacbon lớn thành hydrocacbon nhỏ hơn và tạo ra hiện tượng không bão hòa. Khi nguyên liệu là etan thì sản phẩm là etylen. Polyetylen được tách ra khỏi hỗn hợp hỗn hợp thu được bằng quá trình nén và chưng cất lặp đi lặp lại. Các phương pháp khác để sản xuất ethylene bao gồm, tổng hợp Fischer-Tropsch, khử hydro bằng xúc tác, kết hợp oxy hóa metan và metanol-to-olefin (MTO).
Phương pháp phòng thí nghiệm – Nó hiếm khi được chuẩn bị trong phòng thí nghiệm và thường được mua. Nó có thể được tổng hợp bằng cách khử nước etanol với H2SO4 (axit sunfuric) hoặc với oxit nhôm trong pha khí.
[latex] CH_ {3} -CH_ {2} -OH \ overset {Al_ {2} O_ {3}} {\ rightarrow} CH_ {2} = CH_ {2} + H_ {2} O [/ latex]
Tính chất hóa học của Ethylene:
(a) Đốt cháy (oxi hóa với không khí):
Ethene cháy trong không khí hoặc oxy khi đun nóng tạo thành CO2 và H2O. Các phản ứng cháy có bản chất là tỏa nhiệt lớn.
C2H4 + 3O2 ⟶ 2CO2 + 2H2O
(b) Các phản ứng trùng hợp của etilen:
Phản ứng trùng hợp etilen dẫn đến polythene có hai loại:
Polyetylen mật độ thấp: Nó được điều chế bằng cách nung nóng etilen đến 463-483 K dưới áp suất khoảng 1500 atm. trong sự hiện diện của các dấu vết của oxy.
n [CH2 = CH2] ⟶ [ー CH2 ー CH2 ー] n
Polyetylen tỷ trọng thấp trơ về mặt hóa học, dai và dẫn điện kém.
Polyetylen mật độ cao: Nó được điều chế bằng phản ứng trùng hợp etilen ở khoảng 333-343 K dưới áp suất 6-7 atm. trong chất xúc tác chẳng hạn như chất xúc tác Ziegler Natta. Polyme này cũng trơ về mặt hóa học nhưng khá dai và cứng.
Công dụng của Etylen- C2H4
Ethylene được sử dụng trong sản xuất rượu.
Được sử dụng trong sản xuất polyetylen.
Được sử dụng trong việc thúc đẩy sự lão hóa.
Dùng để sản xuất chất dẻo chế tạo.
Dùng làm thuốc diệt cỏ.
Dùng làm chất đóng rắn cho thuốc lá.
Được sử dụng như một chất làm lạnh.
Được sử dụng như một chất gây mê.
Được sử dụng để đẩy nhanh quá trình chín của trái cây thương mại.
Dùng trong hàn kim loại.
Mối nguy hiểm đối với sức khỏe của Ethylene
Nồng độ trung bình trong không khí có thể gây buồn ngủ, bất tỉnh và chóng mặt. Tiếp xúc quá mức có thể dẫn đến đau đầu, yếu cơ và buồn ngủ. Ngoài ra, hơi của hợp chất này có thể gây ngạt thở. Khi chạm vào ethylene ở dạng lỏng, nó sẽ gây bỏng và thương tích nặng. Khi đốt nóng, ngọn lửa giải phóng các khí khó chịu và độc hại.
Câu hỏi thường gặp-Câu hỏi thường gặp
1. Ai là người phát hiện ra etylen?
Một nhà khoa học người Nga tên là Dimitry Neljubow vào năm 1901 đã chứng minh rằng thành phần hoạt động là ethylene. Sự nghi ngờ được phát hiện ra rằng vào năm 1917 ethylene đã thúc đẩy quá trình áp suất. Cho đến năm 1934, Gane mới công bố rằng các nhà máy tổng hợp ethylene.
2. etylen được sản xuất như thế nào?
Ethylene được phát triển thương mại bằng cách crackinh hơi nước của nhiều loại nguyên liệu hydrocacbon. Các quy trình bẻ khóa olefin và chuyển đổi lẫn nhau đang được xây dựng để nâng cao hiệu quả của olephins nhẹ. Họ thường sẽ chuyển hóa C4-C8 olephins và nhiệt phân xăng nhẹ thành ethylene và propylene.
3. Etylen có nặng hơn không khí không?
Etylen có dạng khí không màu, mùi thơm nhẹ. Nó nhẹ hơn khí quyển.
4. Etylen phân cực hay không phân cực?
Etylen là một chất có tính chất không phân cực. Điều này là do chúng có sự phân bố điện tích bằng nhau, không giống như phân tử phân cực.
5. Chức năng của etilen là gì?
Ở thực vật, etylen hoạt động như một loại hormone. Nó hoạt động ở tốc độ vết trong suốt thời gian sống của cây bằng cách kích thích hoặc kiểm soát sự trưởng thành của trái, sự mở hoa và rụng lá (hoặc rụng).





