Kẽm (Zn) là kim loại màu trắng xanh, sáng bóng, với mật độ 7,14 g / cm3, nó trở nên mềm ở 100-150 ° C, và trở nên giòn sau khi vượt quá 200 ° C.
Kẽm dễ uốn, điểm nóng chảy là 419,58 ° C và điểm sôi là 907 ° C. Có tất cả 15 đồng vị của Kẽm. Kẽm là chất dẫn nhiệt và dẫn điện tốt. Năng lượng ion hóa là 9,394 electron vôn.
Zn hoạt động hơn về tính chất hóa học, nhưng bền trong không khí hơn và sẽ giải phóng hydro khi phản ứng với axit và kiềm. Trong không khí ở nhiệt độ phòng, một màng kẽm cacbonat cơ bản mỏng và dày đặc được hình thành trên bề mặt để ngăn chặn quá trình oxy hóa tiếp tục.
Khi nhiệt độ lên đến 225 ° C, kẽm bị oxy hóa mạnh. Khi cháy, nó phát ra ngọn lửa màu xanh lam. Kẽm dễ dàng hòa tan trong axit, và có thể dễ dàng thay thế vàng (Au), bạc (Ag), đồng (Cu), v.v. khỏi dung dịch.
Mặc dù kẽm thường được sử dụng làm hàng hóa đã được xử lý nhưng những đặc điểm này không còn đặc biệt nữa. Mật độ của nó thấp hơn một chút so với sắt, và nó có cấu trúc tinh thể hình lục giác.
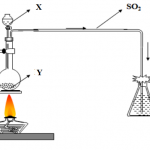
Kẽm bị oxy hóa mạnh khi đun nóng đến 225 ℃, và nó cháy như ngọn lửa xanh, và phản ứng với oxy để tạo thành oxit kẽm:
2 Zn + O2 → 2 ZnO
Phản ứng với halogen để tạo ra kẽm halogenua:
Zn + X2 → ZnX2 (X = F, Cl, Br, I)
Phản ứng với lưu huỳnh để tạo thành kẽm sulfua:
Zn + S → ZnS
Phản ứng với nước : Kẽm phản ứng với hơi nước để tạo thành oxit kẽm:
Zn + H2O (g) → ZnO + H2
Tương tự như nhôm, kẽm cũng là chất lưỡng tính. Kẽm có thể tạo ra tetrahydroxyzincate và hydro với dung dịch kiềm mạnh. Ví dụ, nó phản ứng với natri hydroxit để tạo ra natri tetrahydroxyzinat:
Zn + 2NaOH + 2H2O → Na2 [Zn (OH) 4] + H2 ↑
Trong số các hợp chất của kẽm, hóa trị phổ biến nhất của kẽm là +2. Kẽm có thể tạo hợp chất với tất cả các anion. Chẳng hạn như ZnSO4, ZnCl2, Zn (NO3) 2 thông thường, v.v., các hợp chất kẽm hòa tan có đặc tính hóa lỏng mạnh, chẳng hạn như kẽm clorua và kẽm peclorat. Một số hợp chất nhị phân của kẽm (ZnSe, ZnTe, v.v.) có tính chất hấp dẫn trong quang điện.
Trong số các hợp chất của kẽm, ZnO, Zn (OH) 2 và ZnCO3 hầu như không tan trong nước.
Kẽm (II) có thể tạo phức, chẳng hạn như [Zn (NH3) 4] 2+, [Zn (OH) 4] 2-, [Zn (CN) 4] 2-, v.v. Ngoài ra còn có nhiều hợp chất hữu cơ trong kẽm (II), chẳng hạn như kẽm dietyl.
Kẽm oxit là một chất vô cơ có công thức hóa học là ZnO, là một oxit của kẽm. Khó tan trong nước, tan trong axit và kiềm mạnh. Kẽm oxit là một phụ gia hóa học được sử dụng phổ biến, được sử dụng rộng rãi trong sản xuất nhựa, sản phẩm silicat, cao su tổng hợp, chất bôi trơn, sơn, thuốc mỡ, chất kết dính, thực phẩm, pin, chất chống cháy và các sản phẩm khác.
Sau khi nung thỏi kẽm được tạo ra bằng phương pháp điện phân đến 600-700 ℃ để nấu chảy, đặt nó vào một nồi nung ở nhiệt độ cao, làm cho nó nóng chảy và hóa hơi ở nhiệt độ cao 1250-1300 ℃, đưa không khí nóng vào để oxy hóa, và kẽm oxit tạo ra được làm lạnh, tách Cyclone, thu các hạt mịn bằng túi vải, sau đó thu được thành phẩm là oxit kẽm.
Phương trình phản ứng:
C + O2 = CO2
CO2 + C = 2CO
C + 2ZnO → 2Zn + CO2
ZnO + H2 → Zn + H2O
ZnO + CO = Zn (hơi nước) + CO2
Zn (hơi nước) + CO + O2 = ZnO + CO2