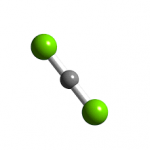
Clo là một chất khí đơn giản và công thức hóa học của nó là Cl2. Ở nhiệt độ và áp suất bình thường, nó có màu vàng xanh, là khí rất độc, có mùi hăng nồng, gây ngạt thở và đặc hơn không khí.
Clo hòa tan trong nước và các dung dịch kiềm, dễ hòa tan trong dung môi hữu cơ (như carbon tetrachloride), và khó hòa tan trong nước muối bão hòa.
Nó rất dễ nén và có thể được hóa lỏng thành clo lỏng màu vàng xanh, là một trong những sản phẩm chính của ngành công nghiệp clor-kiềm và có thể được sử dụng như một chất oxy hóa mạnh.
Khi hydro có thành phần thể tích lớn hơn 5% được trộn với clo, nó có thể phát nổ khi tiếp xúc với ánh sáng mạnh.
Clo là chất độc, xâm nhập vào cơ thể con người chủ yếu qua đường hô hấp và hòa tan trong nước chứa trong niêm mạc, gây tổn thương niêm mạc đường hô hấp trên.
Clo có thể trải qua phản ứng thay thế và phản ứng cộng với các chất hữu cơ và vô cơ để tạo ra các clorua khác nhau. Chủ yếu được sử dụng trong sản xuất nhựa (như PVP), sợi tổng hợp, thuốc nhuộm, thuốc trừ sâu, chất khử trùng, dung môi tẩy trắng và các loại clorua khác nhau.
Nguyên tử clo có 7 electron ở lớp ngoài cùng, dễ dàng nhận 1 electron hoặc dùng chung một cặp electron để đạt được cấu trúc bền vững (liên kết cộng hóa trị) trong phản ứng.
Ở nhiệt độ và áp suất thường, nó là một chất khí màu vàng xanh, mùi hắc. Khối lượng riêng của khí clo gấp 2,5 lần khối lượng riêng của không khí và ρ = 3,21kg / m³ ở điều kiện tiêu chuẩn.
Clo tan trong nước, dễ tan trong dung môi hữu cơ (như cacbon tetraclorua) và khó tan trong nước muối bão hòa. 1 thể tích nước có thể hòa tan 2 thể tích clo ở nhiệt độ thường tạo thành nước clo có màu vàng lục.
Clo ở trạng thái tự do trong tự nhiên tồn tại trong khí quyển, nhưng lúc này, clo thường bị tia cực tím phân hủy thành hai nguyên tử clo (gốc tự do), là một trong những nguyên tố chính phá hủy tầng ozon.
Clo hỗ trợ quá trình đốt cháy, và nhiều chất có thể bị đốt cháy trong clo (trừ một vài chất như nguyên tố cacbon, v.v.)
Phản ứng với natri: Natri bốc cháy dữ dội trong khí clo, sinh ra nhiều khói trắng và tỏa nhiệt mạnh.
2Na + Cl2 = 2NaCl
Phản ứng với đồng: Dây đồng nóng đỏ bốc cháy dữ dội trong clo, bình bốc ra khói màu vàng nâu, sau khi thêm một ít nước vào thì dung dịch chuyển sang màu xanh lam (màu xanh càng rõ), sau khi thêm nước vừa đủ thì dung dịch chuyển hẳn sang màu xanh lam.
Cu + Cl2 = CuCl2
Cho dd Cu(OH)2 tác dụng với axit HCl: Cu(OH)2 + 2HCl ⟶ 2H2O + CuCl2
Phản ứng với sắt: Dây sắt bốc cháy dữ dội trong clo, bình bốc ra khói màu đỏ nâu, sau khi thêm một ít nước vào thì dung dịch chuyển sang màu vàng.
Fe + 3Cl2 = 2FeCl3
Phản ứng với magie: Đốt rất dữ dội, tạo ra khói trắng.
Mg + Cl2 = MgCl2
Khí clo có tính oxi hóa mạnh, phản ứng được với tất cả các kim loại khi đun nóng, ví dụ vàng, bạch kim cháy trong khí clo nóng, phản ứng với kim loại biến chất như Fe, Cu tạo ra clorua kim loại hóa trị cao.
Ở nhiệt độ thường, khí clo khô hoặc clo lỏng không phản ứng với sắt và chỉ có thể phản ứng trong điều kiện nung nóng, do đó có thể dùng bình thép để đựng khí clo (clo lỏng).