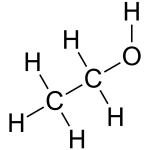
Ethanol là hợp chất hữu cơ, công thức cấu tạo là CH3CH2OH hoặc C2H5OH, công thức phân tử là C2H6O, thường được gọi là ancol.
Ethanol là một chất lỏng dễ bay hơi, không màu và trong suốt ở nhiệt độ và áp suất phòng, có độc tính thấp và chất lỏng tinh khiết không thể tiêu thụ trực tiếp. Dung dịch nước ethanol có mùi rượu, hơi gắt và ngọt.
Ethanol dễ cháy và hơi của nó có thể tạo thành hỗn hợp nổ với không khí. Ethanol có thể trộn lẫn với nước theo bất kỳ tỷ lệ nào, có thể trộn lẫn với cloroform, ete, metanol, axeton và hầu hết các dung môi hữu cơ khác.
Ethanol có thể được sử dụng trong sản xuất axit axetic, đồ uống, hương liệu, thuốc nhuộm, nhiên liệu, … Ethanol với phần thể tích từ 70% đến 75% thường được sử dụng làm chất khử trùng trong y tế.
Ethanol được sử dụng rộng rãi trong công nghiệp hóa chất, y tế và y tế, công nghiệp thực phẩm, sản xuất nông nghiệp và các lĩnh vực khác.
Ethanol là rượu đơn chức no có nhóm hydroxyl, có thể được coi là sản phẩm trong đó nguyên tử hydro trong phân tử etan được thay thế bằng nhóm hydroxyl hoặc sản phẩm trong đó nguyên tử hydro trong phân tử nước được thay thế bằng nhóm etylic. Phân tử ethanol là phân tử phân cực gồm các nguyên tử C, H và O, trong đó các nguyên tử C và O được liên kết với nhau bằng các obitan lai hóa sp³.
Ethanol có tính axit yếu (nói một cách chính xác, nó không có tính axit và không thể làm cho chất chỉ thị axit-bazơ đổi màu), và vì nó chứa các liên kết oxy-hydro phân cực, các anion alkoxy và proton sẽ được tạo ra khi bị ion hóa.
Các kim loại hoạt động như kali, canxi và natri có thể thay thế hydro trong nhóm hydroxyl của etanol để tạo ra alkoxit và hydro, nhưng chúng không phản ứng dữ dội như phản ứng với nước. Alkoxit bị thủy phân nhanh chóng trong nước để tạo ra rượu và kiềm, và dung dịch nước của natri ethoxit có tính kiềm mạnh.
Phản ứng đốt cháy ethanol là phản ứng oxi hóa theo nghĩa rộng. Khi đốt cháy hoàn toàn ethanol, nó phát ra ngọn lửa màu xanh nhạt, tạo ra khí cacbonic và hơi nước, đồng thời tỏa nhiều nhiệt. Khi đốt cháy chưa hoàn toàn ethanol, cacbon monoxit được tạo thành, ngọn lửa màu vàng và tỏa nhiệt.
Trong hóa học hữu cơ, phản ứng oxy hóa đề cập cụ thể đến việc bổ sung oxy hoặc loại bỏ hydro. Ethanol có thể bị khử hydro và bị oxy hóa thành acetaldehyde. Phản ứng này có thể được sử dụng để sản xuất acetaldehyde trong công nghiệp. Trong cơ thể người, ethanol có thể được chuyển hóa thành acetaldehyde nhờ tác dụng của alcohol dehydrogenase (ADH).
Ethanol cũng có thể bị oxy hóa thành axit axetic bởi thuốc tím, và thuốc tím chuyển từ màu tím sang không màu.
Ethanol cũng có thể phản ứng với dung dịch crom trioxit đã axit hóa (hoặc dung dịch kali đicromat có tính axit), khi hơi etanol đi vào silica gel có chứa crom trioxit đã axit hóa (hoặc dung dịch kali dicromat có tính axit), có thể thấy silica gel chuyển từ màu vàng sang Màu vàng xanh cỏ, phản ứng này có thể được sử dụng để kiểm tra xem người lái xe có uống rượu và lái xe hay không.
Một số phản ứng điển hình:
C2H5OH + CuO → CH3CHO + Cu(OH)2 + H2O
C2H5OH + Cu(OH)2 → CH3CHO + 2H2O + Cu