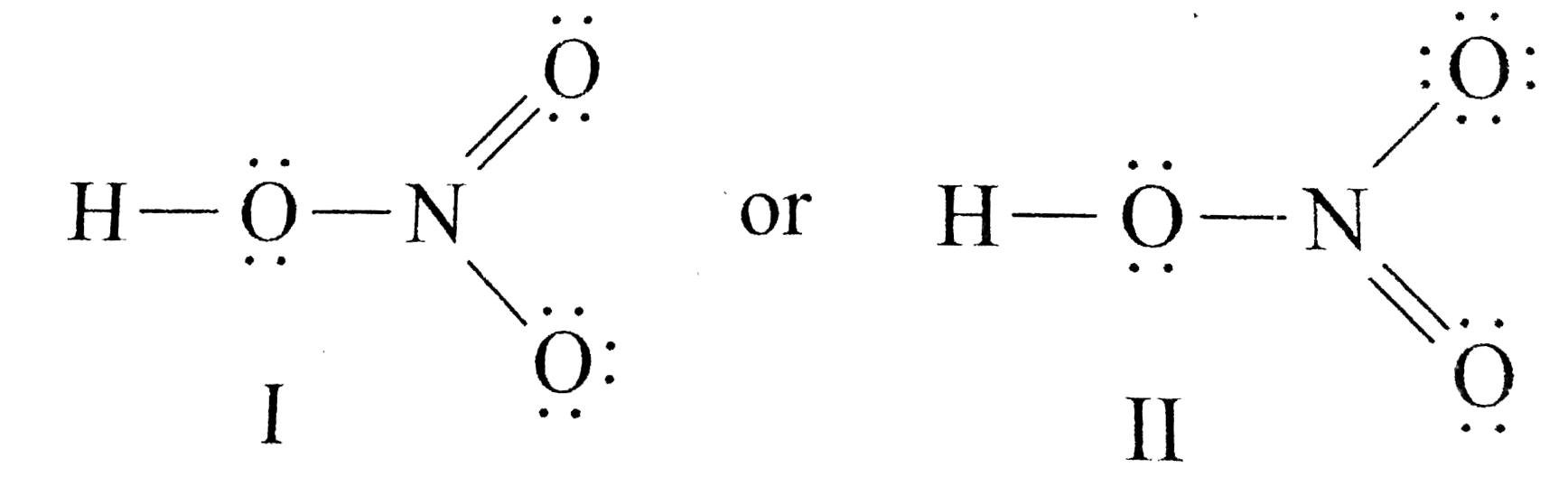
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
8HNO3 + 3Mg → 4H2O + 3Mg(NO3)2 + 2NO
Axit Nitric là gì?
Axit nitric là một axit mạnh có công thức hóa học là HNO3. Nó còn được biết đến như là tinh thần của niter và aqua fortis. Ở dạng nguyên chất, nó không có màu nhưng khi già đi, nó chuyển sang màu vàng. Màu này xuất hiện do sự phân hủy của axit Nitric thành oxit của nitơ và nước. Nó có tính ăn mòn cao và độc hại. Nó gây bỏng da nghiêm trọng. Nó phản ứng với hydroxit, kim loại và oxit để tạo thành muối nitrat.
HNO3 được dùng làm chất oxi hoá mạnh. Nó có thể được sản xuất bằng cách xúc tác quá trình oxy hóa amoniac. Nó là một loại thuốc thử phổ biến được sử dụng trong phòng thí nghiệm và là một hóa chất quan trọng được sử dụng trong các ngành công nghiệp sản xuất chất nổ và phân bón. PH của axit Nitric là khoảng 3,01.
Cấu trúc của phân tử HNO3
Phân tử axit nitric chứa 3 nguyên tử oxy, 1 nguyên tử nitơ và 1 nguyên tử hydro. Trong phân tử HNO3, một trong những nguyên tử oxy được liên kết kép với nguyên tử nitơ trung tâm. Một nguyên tử oxy khác được liên kết đơn lẻ với nguyên tử nitơ trung tâm và cũng liên kết đơn lẻ với nguyên tử hydro. Nguyên tử oxy cuối cùng trong phân tử axit nitric có điện tích -1 và được liên kết đơn lẻ với nguyên tử nitơ trung tâm. Vì nguyên tử nitơ ở trung tâm của phân tử đang tham gia vào bốn liên kết cộng hóa trị (với 3 nguyên tử oxy) nên nó có điện tích là +1. Do đó, điện tích thuần trên phân tử axit nitric bằng 0 (điện tích dương trên nguyên tử nitơ và điện tích âm trên nguyên tử oxi triệt tiêu lẫn nhau). Có thể lưu ý rằng các điện tích trong phân tử này có thể được phân chia do cộng hưởng. Cấu trúc của phân tử axit nitric được minh họa dưới đây.
Phòng thí nghiệm điều chế axit nitric – HNO3
Nguyên tắc
Một axit dễ bay hơi hơn có thể được thay thế khỏi muối của nó bằng một axit ít bay hơi hơn. Đây là nguyên tắc cơ bản trong phòng thí nghiệm điều chế axit nitric.
Hình minh họa
Axit nitric là một axit dễ bay hơi hơn axit sunfuric được thay thế bởi axit sunfuric từ nitrat kim loại.
Chất phản ứng
Lấy 50g kali nitrat (KNO3) + 25ml axit sunfuric (H2SO4) đặc đựng trong bình cầu đáy tròn. Các chất phản ứng được làm nóng đến khoảng 200oC cẩn thận để nhiệt độ không vượt qua 200oC.
Các phản ứng
KNO3 + H2SO4 → KHSO4 + HNO3
(Muối của axit dễ bay hơi hơn + axit ít bay hơi → thay thế axit dễ bay hơi hơn)
Thiết lập thiết bị
Phòng thí nghiệm điều chế axit nitric
Phòng thí nghiệm điều chế axit nitric – HNO3
Phương thức thu thập
Hơi của axit nitric được làm lạnh và ngưng tụ để thu như hình vẽ bên.
Tính chất vật lý của axit nitric – HNO3
Axit nitric HNO3
Khối lượng phân tử / Khối lượng mol 63,01 g / mol
Mật độ 1,51 g / cm³
Điểm sôi 83 ° C
Điểm nóng chảy -42 ° C
Tính chất hóa học của axit nitric – HNO3
Axit nitric là một axit rất mạnh, làm xanh quỳ tím đỏ.
Axit nitric bị phân hủy khi đứng yên tạo thành nitơ đioxit màu nâu. Đây là lý do tại sao nó trở nên nâu theo thời gian mặc dù axit nitric mới không màu.
4HNO3 → 4NO2 + O2 + 2H2O
Axit nitric giải phóng khí hiđro với các kim loại trên hiđro trong dãy hoạt động kim loại.
Mg + 2HNO3 → Mg (NO3) 2 + H2
Mn + 2HNO3 → Mn (NO3) 2 + H2
Công dụng của Axit Nitric
Nó được sử dụng để sản xuất amoni nitrat để sản xuất nhựa, thuốc nhuộm và phân bón
Nó được sử dụng để sản xuất chất nổ như TNT
Nó được sử dụng trong tên lửa nhiên liệu lỏng như một chất oxy hóa
Ở dạng nguyên chất, nó được sử dụng để loại bỏ mụn cơm
Nó được sử dụng như một chất pha tạp hóa học trong điện hóa học





