Axit sunfuric có công thức hóa học là H2SO4, còn được gọi là mẹ của ngành công nghiệp hóa chất. Là một axit bazơ, axit sunfuric có các đặc điểm khác nhau ở các nồng độ khác nhau và tính ăn mòn của nó đối với các chất khác nhau.
Axit sunfuric loãng dùng để chỉ dung dịch nước của axit sunfuric có phần chất tan nhỏ hơn hoặc bằng 70%. Vì các phân tử axit sunfuric trong axit sunfuric loãng đã bị ion hóa hoàn toàn nên axit sunfuric loãng không có các tính chất hóa học đặc biệt của axit sunfuric đặc như oxy hóa mạnh, hấp thụ nước và khử nước (thường được gọi là cacbon hóa, tức là mạnh ăn mòn).
Dưới tác dụng của phân tử nước, các phân tử axit sunfuric ion hóa (phân ly) tạo thành ion hydro (H +) và ion sunfat ( SO42-).
Axit sunfuric loãng làm quỳ tím hóa đỏ, vì axit sunfuric loãng có tính axit, axit có thể làm đổi màu quỳ tím, còn phenolphtalein không đổi màu. Nó cũng có thể được sử dụng để tẩy gỉ vì tính ăn mòn của nó:
Fe2O3 + 3H2SO4 = Fe2 (SO4) 3 + 3H2O
Axit sunfuric loãng có thể phản ứng với các kim loại hoạt động để tạo ra hiđro (Lưu ý: Axit sunfuric đặc sẽ thụ động hóa sắt, do đó nó không thể phản ứng):
Fe + H2SO4 = FeSO4 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Mg + H2SO4 = MgSO4 + H2 ↑
2Al + 3H2SO4 = Al2 (SO4) 3 + 3H2 ↑
Trong một số trường hợp, nó có thể bị khử thành hydro sunfua:
4Mn + 5H2SO4 = 4MnSO4 + 4H2O + H2S ↑
Axit sunfuric loãng có thể phản ứng với oxit kiềm tạo thành muối và nước:
MgO + H2SO4 = MgSO4 + H2O
CuO + H2SO4 = CuSO4 + H2O
Tương tác với kiềm:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + 2KOH = K2SO4 + 2H2O
H2SO4 + Ca (OH) 2 = CaSO4 + 2H2O
Tương tác với muối:
H2SO4 + BaCl2 = BaSO4 ↓ + 2HCl
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
Cho axit sunfuric loãng vào dung dịch bari clorua tạo kết tủa trắng, thêm axit clohiđric loãng thì kết tủa trắng không biến mất.
H2SO4 + BaCl2 = BaSO4 ↓ + 2HCl
Chú ý: BaSO4 là chất rắn màu trắng, không tan trong nước và axit, có thể dùng BaSO4 kết tủa để thử ion sunfat trong dung dịch. Đầu tiên thêm axit clohydric loãng dư để axit hóa dung dịch để loại bỏ nhiễu, sau đó thêm dung dịch BaCl2.
Axit sunfuric đặc là chất lỏng không màu, không mùi, trong suốt ở nhiệt độ thường, tỷ trọng lớn hơn nước, nồng độ axit sunfuric đặc thường dùng là 98% và khối lượng riêng là 1,84g / cm³.
Pha loãng axit sulfuric đậm đặc bằng cách:
Dùng đũa thủy tinh đổ axit sunfuric đặc vào nước hoặc đổ từ từ vào thành trong của bình và tiếp tục khuấy để giải phóng nhiệt do phản ứng hóa học sinh ra. Nếu nóng quá thì làm nguội bằng nước lạnh hoặc nước đá sau đó pha loãng, chỉ cần đạt tỷ lệ hoặc thể tích theo yêu cầu.
Lý do không thể đổ nước vào axit sunfuric đặc: khối lượng riêng của nước nhỏ hơn axit sunfuric đặc và nước sẽ nổi trên bề mặt axit sunfuric đặc. Vì axit sunfuric đặc tan trong nước và thoát ra nhiều khi có nhiệt, nước sẽ ngay lập tức sôi và các giọt nhỏ sẽ di chuyển xung quanh. Để tránh xảy ra tai nạn, cần phải đổ axit sunfuric đặc vào nước thay vì đổ nước vào axit sunfuric đặc.
Các phản ứng hóa học khác của H2SO4:
Cu + 2H2SO4 (đậm đặc) -> CuSO4 + SO2 ↑ + 2H2O
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
H2SO4 + NaOH → NaHSO4 + H2O
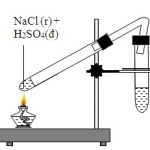
NaCl + H2SO4 -<250oC→ NaHSO4 + HCl↑
2HCl + H2SO4 → Cl2 + 2H2O + SO2