Cân bằng phản ứng
2KMnO4 → MnO2 + O2 + K2MnO4
Nhiệt phân KClO
2KClO → KClO2 + KCl
3KClO2 → 2KClO3 + KCl
4KClO3 → 3KClO4 + KCl
KClO4 → KCl + 2O2
Tìm hiểu về KClO
Potassium Chlorate là gì?
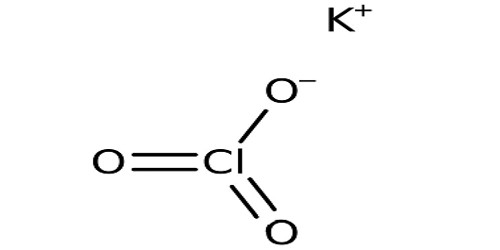
Kali Clorat là một hợp chất vô cơ có công thức hóa học KClO3.
Nó còn được gọi là Fekabit hoặc Kaliumchlorat. Nó rất dễ cháy khi trộn với các vật liệu dễ cháy. Nó là một hợp chất có chứa kali, oxy và clo. Nó xuất hiện như một chất kết tinh màu trắng ở dạng nguyên chất. Đây là ngành công nghiệp sử dụng rộng rãi clorat nhất.
Dung dịch nước của kali clorat là một chất lỏng không màu, đặc hơn nước. Nó có thể gây độc khi ăn phải. Khi tiếp xúc, nó có thể gây kích ứng mắt, da, niêm mạc của bạn. Nó có tính mát và vị mặn.
Điều chế Kali clorat
Kali clorat có thể được sản xuất theo ba cách:
1. Ở quy mô công nghiệp, nó có thể được sản xuất thông qua quy trình Liebig:
Bước 1. Xem xét canxi hiđroxit nóng.
Bước 2. Cho clo vào.
Bước 3. Thêm kali clorua.
6 Ca (OH) 2 + 6 Cl2 → Ca (ClO3) 2 + 5 CaCl2 + 6 H2O
Ca (ClO3) 2 + 2 KCl → 2 KClO3 + CaCl2
2. Kali clorat được tạo ra bằng cách cân đối:
Bước 1. Xem xét dung dịch natri hypoclorit
Bước 2. Phản ứng tổng hợp cùng với kali clorua
3 NaOCl (aq) → 2 NaCl (s) + NaClO3 (aq)
KCl (aq) + NaClO3 (aq) → NaCl (aq) + KClO3 (s)
3. Phương pháp ba:
Bước 1. Xem xét một giải pháp nóng của kali ăn da
Bước 2. Sục khí clo vào
3 Cl2 (g) + 6 KOH (aq) → KClO3 (aq) + 5 KCl (aq) + 3 H2O (l)
Tính chất của Kali clorat – KClO3
KClO3 Kali clorat
Khối lượng phân tử / Khối lượng mol 122,55 g / mol
Mật độ 2,34 g / cm³
Điểm sôi 400 ° C
Điểm nóng chảy 356 ° C
Công dụng của Kali clorat (KClO3)
Kali clorat cùng với fulminat bạc được sử dụng trong các chất tạo tiếng ồn như cá hồng và bánh quy giòn.
Nó được sử dụng như một chất oxy hóa trong lựu đạn khói.
Nó được sử dụng để tạo ra khí oxy trong phòng thí nghiệm của trường đại học và trường học.
Nó được sử dụng trong nến oxy hoặc nến clorat.
Nó được sử dụng trong đèn sân khấu để cung cấp oxy.
Nó được sử dụng như một loại thuốc trừ sâu.
Nó được sử dụng để gầm gừ gấu.
Nó được sử dụng làm phân bón như một giải pháp thay thế hiệu quả cho nitrat amoni.
Nó được sử dụng trong sản xuất giấy.
Nó được sử dụng trong sản xuất diêm.
Nó được sử dụng trong việc sản xuất chất nổ.
Câu hỏi thường gặp – Câu hỏi thường gặp
Kali clorat được sử dụng để làm gì?
Kali clorat được sử dụng trong máy tạo oxy hóa học (còn được gọi là nến clorat hoặc nến oxy), được sử dụng làm hệ thống cung cấp oxy, chẳng hạn như máy bay, trạm vũ trụ và tàu ngầm, và là nguyên nhân khiến ít nhất một máy bay bị rơi.
Điều gì xảy ra với kali clorat khi đun nóng?
Kali clorat bị phân hủy thành kali clorua và khí oxi khi đun nóng mạnh. Khi có mặt MnO2 làm chất xúc tác, sự phân hủy diễn ra nhanh hơn.
Sự khác biệt giữa kali clorua và kali clorat là gì?
Kali clorat là một chất oxy hóa hữu ích và rất dễ sử dụng các hóa chất gia dụng để sản xuất một lượng nhỏ nó. Việc thêm kali clorua di chuyển các ion, kết tủa kali clorat ra ngoài. Để phản ứng này hoạt động, cần đun sôi; bạn không thể để thuốc tẩy bay hơi.
Sự phân huỷ kali clorat có phải là phản ứng oxi hoá khử không?
Sự phân hủy nhiệt kali clorat không quá mức, nó chỉ là một phản ứng oxy hóa khử. Sự không cân đối dùng để chỉ cùng một sản phẩm có chức năng vừa là chất oxi hóa vừa là chất khử, dẫn đến các hợp chất chứa cùng một sản phẩm ở các trạng thái oxi hóa khác nhau.
Kali clorat bị phân hủy như thế nào?
Sự phân hủy nhiệt của kali clorat để thu được oxi và kali clorua. Phản ứng này xảy ra ở nhiệt độ từ 150-300 ° C. Đối với phản ứng này, mangan (IV) oxit có thể là chất xúc tác.