Metanal là gì
Metanal hay còn gọi là formaldehyde là chất khí không màu, có mùi khó chịu đặc biệt, là chất hữu cơ có tác dụng kích thích mắt, mũi của con người.
Công thức metanal
Nguyên tử C tạo liên kết σ với orbital lai hóa sp2, và phân tử là một phân tử tam giác phẳng với góc liên kết khoảng 120 °. Công thức metanal là CH2O.
phản ứng metanol ra metanal
CH3OH + CuO → Cu + H2O + HCHO
phương trình metanal agno3
4AgNO3 + 2H2O + HCHO + 6NH3 → (NH4)2CO3 + 4Ag + 4NH4NO3
metanol là gì
Metanol, còn được gọi là hydroxymetan, là một hợp chất hữu cơ và là rượu đơn chức no đơn giản nhất. Công thức hóa học của nó là CH3OH / CH4O, trong đó CH3OH là một công thức cấu trúc đơn giản, có thể làm nổi bật nhóm hydroxyl của metanol. Số CAS là 67- 56 -1, trọng lượng phân tử là 32,04 và nhiệt độ sôi là 64,7 ° C.
Do được phát hiện lần đầu tiên trong gỗ chưng cất khô nên nó còn được gọi là “cồn gỗ” hay “tinh chất gỗ”. Liều thấp nhất của ngộ độc qua đường uống ở người là khoảng 100mg / kg thể trọng, và đường uống từ 0,3 đến 1g / kg có thể gây tử vong. Nó được sử dụng trong sản xuất formaldehyde và thuốc trừ sâu, và như một chất chiết xuất cho các chất hữu cơ và một chất biến tính cho rượu.
công thức metanol
Công thức hóa học của metanol là CH3OH / CH4O.
metan là gì
Metan là hợp chất hữu cơ có công thức phân tử là CH4 và khối lượng phân tử là 16,043. Metan là chất hữu cơ đơn giản nhất và là hiđrocacbon ít cacbon (nhất). Khí metan phân bố rộng rãi trong tự nhiên và là thành phần chính của khí tự nhiên, khí sinh học, khí hầm lò, … thường được gọi là khí đốt.
Metan có thể được sử dụng làm nhiên liệu và nguyên liệu để sản xuất hydro, carbon đen, carbon monoxide, acetylene, axit hydrocyanic và formaldehyde.
phương trình metan ra axetilen
CH4 → C2H2 + H2
phương trình phản ứng natri axetat ra metan
CH3COONa + NaOH → CH4 + Na2CO3
Cách điều chế metan trong phòng thí nghiệm
Đốt khí metan nguyên chất, đậy một cốc khô trên ngọn lửa, chẳng bao lâu bạn sẽ thấy hơi nước ngưng tụ trên thành cốc. Lật ngược cốc, thêm một ít nước vôi trong, lắc đều, nước vôi trong trở nên vẩn đục. Giải thích rằng quá trình đốt cháy khí metan tạo ra nước và khí cacbonic.
Thu khí metan vào một ống trụ thủy tinh cao, đặt thẳng đứng trên bàn, lấy mảnh thủy tinh ra, cho nhanh thìa đang cháy có ngọn nến đang cháy vào trong ống trụ, ngọn lửa nến bị dập tắt ngay nhưng có khí metan cháy ở miệng của chai, phát ra ngọn lửa màu xanh nhạt.
Điều này cho thấy khí metan có thể cháy lặng lẽ trong không khí, nhưng không hỗ trợ quá trình đốt cháy. Dùng ống nghiệm lớn cho vào trước tiên 2/3 thể tích khí oxi từ bình chứa khí oxi bằng phương pháp thoát khí, sau đó đưa 1/3 thể tích khí metan vào.
Đậy bằng nút cao su và loại bỏ bề mặt nước. Đảo ngược ống nhiều lần để trộn đều các khí. Dùng vải đậy bên ngoài ống nghiệm, để miệng ống nghiệm hơi nghiêng xuống, bỏ nút, dùng thanh gỗ nhỏ đốt cháy nhanh lên miệng ống nghiệm phát ra tiếng lộp độp.
Thí nghiệm này, mặc dù đơn giản, nhưng cũng dễ bị thất bại. Đốt khí metan thoát ra từ miệng ống thủy tinh cho vào bình đựng đầy khí clo thì metan sẽ tiếp tục cháy, cho ngọn lửa màu vàng đỏ, ta thấy có khói đen và sương mù trắng. Khói đen có màu đen carbon, và sương mù trắng là những giọt axit clohydric được tạo thành bởi khí hydro clorua và hơi nước.
metan có nhiều trong đâu
Metan và hydro cũng có trong bầu khí quyển của Sao Thiên Vương. Theo các thí nghiệm được thực hiện bởi các nhà khoa học tại Viện Vật lý Hạt nhân Đức, cả cây và lá rụng đều tạo ra khí mê-tan, và lượng khí metan được tạo ra sẽ tăng lên theo nhiệt độ và ánh sáng mặt trời. Thêm vào đó, thực vật tạo ra khí metan nhiều hơn từ 10 đến 100 lần so với thực vật đang thối rữa. Họ ước tính rằng các nhà máy sản xuất từ 10% đến 30% sản lượng khí mê-tan trên thế giới mỗi năm.
Khí metan tìm thấy trong các hành tinh Theo báo chí nước ngoài đưa tin, các nhà thiên văn học Mỹ ngày 19 thông báo rằng họ đã lần đầu tiên phát hiện ra khí metan trong bầu khí quyển của một hành tinh ngoài hệ mặt trời, mang lại hy vọng cho sự sống.
Công thức hóa học của metan
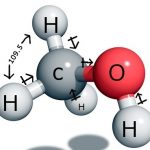
Metan, công thức hóa học CH4, là hiđrocacbon đơn giản nhất, gồm một nguyên tử cacbon và 4 nguyên tử hiđro qua lai hóa sp3 nên cấu tạo của phân tử metan là cấu tạo tứ diện đều, độ dài liên kết của 4 liên kết là như nhau và liên kết các góc bằng nhau.
cấu tạo của metan
Metan là chất khí không màu, không mùi ở điều kiện tiêu chuẩn. Khí sinh học được tạo ra khi một số chất hữu cơ bị phân hủy trong điều kiện không có oxy thực chất là khí metan. Về mặt lý thuyết, dạng đường liên kết của metan có thể được biểu diễn dưới dạng điểm “·”, nhưng chúng ta chưa bao giờ thấy cách sử dụng như vậy trong thực tế. Lý do có thể là dấu “·” cũng có thể biểu diễn các electron. Vì vậy, hãy nghĩ về metan như một loại không liên kết ở trường trung học cơ sở.
Khí metan chủ yếu được sử dụng làm nhiên liệu, chẳng hạn như khí đốt tự nhiên và khí than, và được sử dụng rộng rãi trong các ứng dụng dân dụng và công nghiệp. Là một nguyên liệu hóa học, nó có thể được sử dụng để sản xuất axetylen, hydro, amoniac tổng hợp, cacbon đen, cacbon disunfua, clorometan, diclometan, cloroform, cacbon tetraclorua và axit hydrocyanic, v.v.
metanal + o2
2HCHO + O2 → 2HCOOH
Tính chất hóa học của metan
Ở những trường hợp bình thường, metan tương đối bền và không phản ứng với chất oxi hóa mạnh như thuốc tím, cũng như không phản ứng với axit và kiềm mạnh. Nhưng trong những điều kiện nhất định, metan cũng có thể trải qua một số phản ứng nhất định.
Phản ứng thay thế
Quá trình halogen hóa metan chủ yếu bao gồm quá trình clo hóa và brom hóa. Phản ứng giữa metan và flo tỏa nhiều nhiệt, một khi phản ứng xảy ra rất nhiều nhiệt khó thoát ra, phá hủy flo sinh ra, chỉ thu được cacbon và hiđro florua. Do đó, phản ứng flo hóa trực tiếp khó thực hiện được, cần phải pha loãng bằng khí hiếm. Phản ứng của iot và metan đòi hỏi năng lượng hoạt hóa cao, và phản ứng khó thực hiện. Do đó, iot không thể phản ứng trực tiếp với metan để tạo ra metyl iodua. Nhưng phản ứng ngược của nó rất dễ thực hiện.
Phản ứng oxi hóa metan cơ bản nhất là phản ứng cháy:
CH4 + 2O2 → CO2 + 2H2O
Hàm lượng hiđro của metan cao nhất trong các hiđrocacbon, đạt 25% nên đốt cháy hoàn toàn các hiđrocacbon ở thể khí có cùng khối lượng thì metan tiêu thụ oxi là lớn nhất.
Phân hủy nhiệt
Trong điều kiện cách ly không khí và nung nóng đến 1000 ℃, metan bị phân hủy tạo thành muội than và hydro. Hydro là nguyên liệu thô tổng hợp amoniac và xăng dầu và các ngành công nghiệp khác; muội than là nguyên liệu thô của ngành công nghiệp cao su.
Tạo thành hydrat
Khí metan có thể tạo thành các hydrat dạng lồng, trong đó khí metan được bao bọc trong các “lồng”. Còn được gọi là băng dễ cháy. Nó là một hợp chất tinh thể giống băng, không phân tầng, dạng lồng (cacbon có độ âm điện lớn, và có thể hút các nguyên tử hydro lại gần nó để tạo liên kết hydro dưới áp suất cao tạo thành cấu trúc dạng lồng). Nó có thể được biểu diễn bằng mCH4 · nH2O, trong đó m đại diện cho các phân tử khí trong hiđrat, và n là chỉ số hiđrat hóa (tức là số phân tử nước).
CH4 là axit, hay bazo
Metan là nhiên liệu rất quan trọng và là thành phần chính của khí tự nhiên, chiếm khoảng 87%. Ở nhiệt độ phòng ở áp suất tiêu chuẩn, mêtan không màu và không mùi; hương vị đặc biệt của khí đốt tự nhiên gia dụng là mùi nhân tạo được thêm vào để an toàn, thường là với metyl mercaptan hoặc etan mercaptan.
Tại một bầu không khí, nhiệt độ sôi của metan là -161 ° C. Hàm lượng khí trong không khí rất dễ cháy miễn là nó vượt quá 5% đến 15%. Khí metan hóa lỏng không cháy trừ khi ở trong môi trường áp suất cao (thường là 4 đến 5 atm).
Axit etanoic
Axit etanoic, còn được gọi là axit axetic hoặc axit axetic băng, có công thức hóa học là CH3COOH hoặc HC2H3O2, là một axit đơn bazơ hữu cơ và axit béo bão hòa mạch ngắn, là nguồn gây ra mùi chua và hăng trong giấm. Axit axetic tinh khiết gần như khan (với hàm lượng nước dưới 1%) được gọi là “axit axetic băng”, là một tinh thể hút ẩm không màu với điểm đóng băng 16 ~ 17 ° C (62 ° F). Mặc dù axit axetic là một axit yếu, có tính ăn mòn, hơi của nó gây khó chịu cho mắt và mũi và có mùi chua hăng.
Axit axetic là axit cacboxylic đơn giản thứ hai (sau axit fomic), và phân tử của nó bao gồm một nhóm metyl và một nhóm cacboxyl.
Axit axetic là một tác nhân hóa học quan trọng; trong công nghiệp hóa chất, nó được sử dụng để sản xuất polyethylene terephthalate, thành phần chính trong chai nước giải khát.
Axit axetic cũng được sử dụng để tạo axetat xenluloza cho phim chuyển động và polyvinyl axetat trong chất kết dính gỗ, cũng như nhiều loại sợi tổng hợp và vải. Trong gia đình, dung dịch axit axetic loãng thường được dùng làm chất tẩy cặn.
Ch3oh là gì
Metanol (tiếng Anh: Methanol, hoặc Methyl alcohol; công thức phân tử: CH3OH hoặc MeOH), còn được gọi là hydroxymethane, rượu gỗ và rượu mạnh gỗ, là một hợp chất hữu cơ và rượu đơn giản nhất. Methanol có tên gọi là “cồn gỗ” và “tinh chất gỗ”, vì phương pháp sản xuất chính của nó là chiết xuất từ giấm gỗ (một trong những sản phẩm của quá trình chưng cất khô hoặc vò gỗ). Metanol hiện đại được sản xuất trực tiếp từ carbon monoxide, carbon dioxide và hydro trong một quy trình công nghiệp có xúc tác.
metanal + agno3/nh3
2AgNO3 + H2O + HCHO + 3NH3 => 2Ag + 2NH4NO3 + HCOONH4
metanal + br2
HCHO + Br2 + H2O → HCOOH + 2HBr
Metanal là chất gì
Metanal (tiếng Anh: Formaldehyde), công thức hóa học HCHO, khối lượng 30,03, còn gọi là fomanđehit, là một hợp chất hữu cơ có trong tự nhiên. Chất khí gây kích ứng không màu, dễ tan trong nước, gây khó chịu cho mắt, mũi và da của con người. Dung dịch fomanđehit 40% phần trăm thể tích còn được gọi là fomanđehit.
Tỷ trọng tương đối của khí là 1,067 (không khí là 1), và tỷ trọng của chất lỏng là 0,815g / cm³ (-20 ℃). Nó chủ yếu được sử dụng trong sản xuất nhựa công nghiệp như ván dăm và chất phủ. Sản lượng formaldehyde hàng năm vào năm 1996 là khoảng 8,7 triệu tấn.
So với nhiều hợp chất cacbon đơn giản, formaldehyde phức tạp hơn do có nhiều dạng khác nhau. Là một chất khí, fomanđehit có mùi hắc đặc biệt, một chất khí không màu. Khi ngưng tụ, khí được chuyển thành nhiều dạng khác của fomanđehit (với các công thức hóa học khác nhau), có tính thực tế cao hơn.
metanol + cuoh2
CH3OH + 2 Cu(OH)2 → CH2O + Cu2O + 3 H2O
metanol + NaOH
2 CH3OH + NAOH → C2H5ONA + 2H2O
metanol + k
2 CH3OH + 2 K → 2 CH3OK + H2
metanol + hbr
CH3OH + HBr → CH3Br + H2O