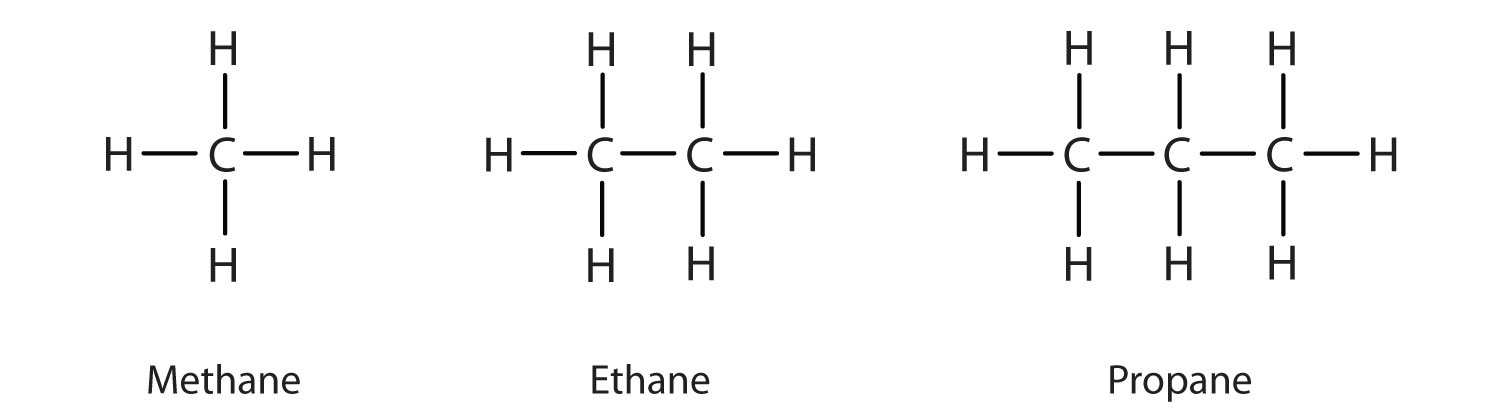
Định nghĩa ankan
Hóa học hữu cơ, ankan, hoặc parafin (một cái tên tầm thường trong lịch sử cũng có những ý nghĩa khác), là một hiđrocacbon no mạch hở. Nói cách khác, một ankan bao gồm các nguyên tử hydro và cacbon được sắp xếp theo cấu trúc cây, trong đó tất cả các liên kết cacbon-cacbon là đơn lẻ. [1] Các ankan có công thức hóa học chung là CnH2n + 2. Các ankan có mức độ phức tạp từ trường hợp đơn giản nhất là metan (CH4), trong đó n = 1 (đôi khi được gọi là phân tử mẹ), đến các phân tử lớn và phức tạp tùy ý, như pentacontan (C50H102) hoặc 6-etyl-2-metyl-5- (1-metyletyl) octan, một đồng phân của tetradecan (C14H30).
Liên minh Quốc tế về Hóa học Tinh khiết và Ứng dụng (IUPAC) định nghĩa ankan là “hydrocacbon mạch hở có nhánh hoặc không phân nhánh có công thức chung là CnH2n + 2 và do đó bao gồm hoàn toàn các nguyên tử hydro và nguyên tử cacbon bão hòa”. Tuy nhiên, một số nguồn sử dụng thuật ngữ này để biểu thị bất kỳ hiđrocacbon no nào, bao gồm cả những hiđrocacbon đơn chức (tức là xycloalkanes) hoặc đa vòng, [2] mặc dù chúng có công thức chung riêng biệt (tức là xicloalkanes là CnH2n).
Trong một ankan, mỗi nguyên tử cacbon được lai hóa sp3 với 4 liên kết sigma (hoặc C – C hoặc C – H), và mỗi nguyên tử hydro được liên kết với một trong các nguyên tử cacbon (trong liên kết C – H). Chuỗi nguyên tử cacbon liên kết dài nhất trong phân tử được gọi là bộ xương cacbon hay xương sống cacbon của nó. Số lượng nguyên tử cacbon có thể được coi là kích thước của ankan.
Một nhóm của ankan cao hơn là sáp, chất rắn ở nhiệt độ và áp suất môi trường tiêu chuẩn (SATP), trong đó số nguyên tử cacbon trong xương sống cacbon lớn hơn khoảng 17. Với các đơn vị –CH2 lặp đi lặp lại của chúng, các ankan tạo thành một dãy đồng đẳng. hợp chất hữu cơ trong đó các thành viên khác nhau về khối lượng phân tử bội số của 14,03 u (tổng khối lượng của mỗi đơn vị cầu metylen như vậy, bao gồm một nguyên tử cacbon duy nhất có khối lượng 12,01 u và hai nguyên tử hydro có khối lượng ~ 1,01 u mỗi nguyên tử).
Mêtan được tạo ra bởi vi khuẩn sinh metan và một số ankan chuỗi dài có chức năng như pheromone ở một số loài động vật nhất định hoặc như chất sáp bảo vệ ở thực vật và nấm. Tuy nhiên, hầu hết các ankan không có nhiều hoạt tính sinh học. Chúng có thể được xem như cây phân tử mà trên đó có thể treo các nhóm chức năng hoạt động / phản ứng mạnh hơn của các phân tử sinh học.
Các ankan có hai nguồn thương mại chính: dầu mỏ (dầu thô) và khí đốt tự nhiên.
Nhóm alkyl là một đoạn phân tử gốc ankan mang một hóa trị mở để tạo liên kết. Chúng thường được viết tắt bằng ký hiệu cho bất kỳ nhóm organyl nào, R, mặc dù Alk đôi khi được sử dụng để ký hiệu cụ thể cho một nhóm alkyl (trái ngược với nhóm alkenyl hoặc nhóm aryl).
Đặc điểm cấu tạo của ankan
Thông thường khoảng cách liên kết đơn C-C là 1,53 ångströms (1,53 × 10−10 m). Các hydrocacbon bão hòa có thể là mạch thẳng, mạch nhánh hoặc mạch vòng. Nhóm thứ ba đôi khi được gọi là xycloalkanes. Cấu trúc rất phức tạp có thể bằng cách kết hợp các ankan mạch thẳng, mạch nhánh, mạch vòng.
Tính chất hóa học đặc trưng của ankan
Tính chất hóa học của ankan
Ankan là loại hợp chất hữu cơ ít phản ứng nhất. Các ankan không hoàn toàn không phản ứng. Hai phản ứng quan trọng mà chúng trải qua là quá trình đốt cháy, đó là phản ứng với oxy và halogen, là phản ứng với halogen.
1. Đốt cháy
Phản ứng cháy là một phản ứng hóa học giữa một chất và oxy, diễn ra sự biến đổi nhiệt và ánh sáng. Các ankan dễ dàng trải qua các phản ứng cháy khi bắt lửa. Khi có đủ oxy để hỗ trợ quá trình đốt cháy hoàn toàn thì carbon dioxide và nước là các sản phẩm.
CH4 + 2O2 → CO2 + 2H2O + năng lượng
2C6H14 + 19O2 → 12CO2 + 14H2O + năng lượng
Bản chất tỏa nhiệt của phản ứng đốt cháy ankan giải thích việc sử dụng rộng rãi ankan làm nhiên liệu. Khí tự nhiên, được sử dụng trong sưởi ấm gia đình chủ yếu là khí mêtan.
2. Halogen hóa
Halogen hóa một ankan tạo ra một dẫn xuất hydrocacbon trong đó một hoặc nhiều nguyên tử halogen đã được thay thế cho nguyên tử hydro. Một ví dụ về phản ứng halogen hóa ankan là
CH3-CH3 + Br2 → CH3-CH2-Br + HBr
Sự halogen hóa ankan là một ví dụ về phản ứng thế một loại phản ứng thường xảy ra trong hóa học hữu cơ.
Phương trình tổng quát cho sự thay thế một nguyên tử halogen đơn lẻ cho một trong các nguyên tử hydro của ankan là
R-H + X2 → R-X + H-X
Tính chất vật lý của Ankan
Điểm sôi
Điểm nóng chảy (màu xanh lam) và điểm sôi (màu da cam) của 16 n-ankan đầu tiên ở ° C.
Các ankan trải qua lực van der Waals giữa các phân tử. Lực van der Waals liên phân tử mạnh hơn làm tăng nhiệt độ sôi của ankan.
Có hai yếu tố quyết định sức mạnh của lực van der Waals:
số lượng các electron xung quanh phân tử, tăng theo khối lượng phân tử của ankan
diện tích bề mặt của phân tử
Ở điều kiện tiêu chuẩn, ankan từ CH4 đến C4H10 đều ở thể khí; từ C5H12 đến C17H36 chúng là chất lỏng; và sau C18H38 chúng là chất rắn. Vì điểm sôi của ankan chủ yếu được xác định bằng trọng lượng, nên không có gì ngạc nhiên khi điểm sôi gần như có mối quan hệ tuyến tính với kích thước (khối lượng phân tử) của phân tử. Theo quy luật chung, điểm sôi tăng 20–30 ° C cho mỗi carbon được thêm vào chuỗi; quy tắc này áp dụng cho các chuỗi tương đồng khác.
Một ankan mạch thẳng sẽ có nhiệt độ sôi cao hơn một ankan mạch nhánh do diện tích bề mặt tiếp xúc lớn hơn, do đó lực van der Waals giữa các phân tử liền kề lớn hơn. Ví dụ, so sánh isobutan (2-metylpropan) và n-butan (butan), sôi ở -12 và 0 ° C, và 2,2-đimetylbutan và 2,3-đimetylbutan lần lượt sôi ở 50 và 58 ° C. .
Mặt khác, xicloalkanes có xu hướng có nhiệt độ sôi cao hơn so với các đối tác tuyến tính của chúng do các cấu trúc bị khóa của các phân tử, tạo ra một mặt phẳng tiếp xúc giữa các phân tử.
Điểm nóng chảy
Điểm nóng chảy của ankan có xu hướng tương tự như điểm sôi vì lý do tương tự như đã nêu ở trên. Nghĩa là, (tất cả những thứ khác bằng nhau) phân tử càng lớn thì nhiệt độ nóng chảy càng cao. Có một sự khác biệt đáng kể giữa điểm sôi và điểm nóng chảy. Chất rắn có cấu trúc cứng và cố định hơn chất lỏng. Cấu trúc cứng nhắc này đòi hỏi năng lượng để phá vỡ. Vì vậy, các cấu trúc vững chắc được ghép lại với nhau càng tốt sẽ cần nhiều năng lượng hơn để phá vỡ. Đối với ankan, điều này có thể được nhìn thấy từ biểu đồ trên (tức là đường màu xanh lam). Các ankan số lẻ có xu hướng nhiệt độ nóng chảy thấp hơn các ankan số chẵn. Điều này là do các ankan được đánh số chẵn đóng gói tốt trong pha rắn, tạo thành một cấu trúc có tổ chức tốt, đòi hỏi nhiều năng lượng hơn để phá vỡ. Các ankan số lẻ đóng gói kém hơn và do đó, cấu trúc đóng gói rắn có tổ chức “lỏng lẻo hơn” cần ít năng lượng hơn để phá vỡ. Để có hình dung về các cấu trúc tinh thể, hãy xem.
Điểm nóng chảy của ankan mạch nhánh có thể cao hơn hoặc thấp hơn điểm nóng chảy của ankan mạch thẳng tương ứng, một lần nữa tùy thuộc vào khả năng đóng gói tốt của ankan được đề cập trong pha rắn.
Độ dẫn điện và độ hòa tan
Các ankan không dẫn điện theo bất kỳ cách nào, và về cơ bản chúng cũng không bị phân cực bởi điện trường. Vì lý do này, chúng không hình thành liên kết hydro và không hòa tan trong dung môi phân cực như nước. Vì các liên kết hydro giữa các phân tử nước riêng lẻ được sắp xếp cách xa phân tử ankan, nên sự tồn tại chung của một ankan và nước dẫn đến sự gia tăng trật tự phân tử (giảm entropi). Vì không có liên kết đáng kể giữa các phân tử nước và phân tử ankan, định luật thứ hai của nhiệt động lực học cho rằng nên giảm thiểu sự giảm entropi này bằng cách giảm thiểu sự tiếp xúc giữa ankan và nước: Các ankan được cho là kỵ nước vì chúng không hòa tan trong nước.
Khả năng hòa tan của chúng trong dung môi không phân cực tương đối cao, một đặc tính được gọi là tính ưa béo. Ví dụ, ankan có thể trộn lẫn với nhau theo mọi tỷ lệ.
Khối lượng riêng của ankan thường tăng theo số nguyên tử cacbon nhưng vẫn ít hơn khối lượng riêng của nước. Do đó, ankan tạo thành lớp trên trong hỗn hợp ankan-nước.
Ứng dụng của ankan trong đời sống
Các ứng dụng của ankan phụ thuộc vào số nguyên tử cacbon. Bốn ankan đầu tiên được sử dụng chủ yếu cho mục đích sưởi ấm và nấu ăn, và ở một số quốc gia để phát điện. Mêtan và etan là thành phần chính của khí tự nhiên; chúng thường được lưu trữ dưới dạng khí dưới áp suất. Tuy nhiên, vận chuyển chúng dưới dạng chất lỏng dễ dàng hơn: Điều này đòi hỏi cả quá trình nén và làm mát khí.
Propan và butan là những chất khí ở áp suất khí quyển có thể được hóa lỏng ở áp suất khá thấp và thường được gọi là khí hóa lỏng (LPG). Propan được sử dụng trong các đầu đốt khí propan và làm nhiên liệu cho các phương tiện giao thông đường bộ, [51] butan trong máy sưởi không gian và bật lửa thuốc lá dùng một lần. Cả hai đều được sử dụng làm chất đẩy trong bình xịt aerosol.
Từ pentan đến octan, ankan là chất lỏng dễ bay hơi. Chúng được sử dụng làm nhiên liệu trong động cơ đốt trong, vì chúng bay hơi dễ dàng khi đi vào buồng đốt mà không tạo thành các giọt nhỏ, điều này sẽ làm giảm sự đồng nhất của quá trình đốt cháy. Các ankan mạch nhánh được ưa thích hơn vì chúng ít bị bắt lửa sớm, gây kích nổ hơn nhiều so với các đồng đẳng mạch thẳng của chúng. Xu hướng bắt lửa sớm này được đo bằng chỉ số octan của nhiên liệu, trong đó 2,2,4-trimethylpentan (isooctan) có giá trị tùy ý là 100 và heptan có giá trị bằng không. Ngoài việc sử dụng làm nhiên liệu, ankan ở giữa còn là dung môi tốt cho các chất không phân cực.
Ví dụ, ankan từ nonane đến hexadecan (một ankan có 16 nguyên tử cacbon) là chất lỏng có độ nhớt cao hơn, ngày càng ít thích hợp để sử dụng trong xăng. Thay vào đó, chúng tạo thành phần chính của dầu diesel và nhiên liệu hàng không. Nhiên liệu điêzen được đặc trưng bởi số cetan của chúng, cetan là tên cũ của hexadecan. Tuy nhiên, điểm nóng chảy cao hơn của các ankan này có thể gây ra các vấn đề ở nhiệt độ thấp và ở các vùng cực, nơi nhiên liệu trở nên quá đặc để có thể chảy chính xác.
Các ankan từ hexadecan trở lên tạo thành các thành phần quan trọng nhất của dầu nhiên liệu và dầu bôi trơn. Ở chức năng thứ hai, chúng hoạt động đồng thời như chất chống ăn mòn, vì bản chất kỵ nước của chúng có nghĩa là nước không thể tiếp cận bề mặt kim loại. Nhiều ankan rắn được sử dụng làm sáp parafin, ví dụ, trong nến. Tuy nhiên, không nên nhầm lẫn điều này với sáp thật, chủ yếu bao gồm các este.
Các ankan có chiều dài chuỗi xấp xỉ 35 nguyên tử cacbon trở lên được tìm thấy trong bitum, ví dụ, được sử dụng trong việc rải mặt đường. Tuy nhiên, ankan cao hơn có giá trị nhỏ hơn và thường được tách thành ankan thấp hơn bằng cách crackinh.
Một số polyme tổng hợp như polyetylen và polypropylen là các ankan có chuỗi chứa hàng trăm hoặc hàng nghìn nguyên tử cacbon. Những vật liệu này được sử dụng trong vô số ứng dụng, và hàng tỷ kg vật liệu này được sản xuất và sử dụng mỗi năm.