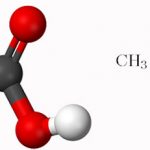
Axit axetic, công thức hóa học CH3COOH, là một axit đơn chức hữu cơ, là nguyên nhân gây ra vị chua và mùi hăng trong giấm. Axit axetic khan tinh khiết (axit axetic băng) là một chất lỏng không màu, hút ẩm với điểm đóng băng là 16,7 ° C (62 ° F), là một tinh thể không màu sau khi đông đặc. Mặc dù axit axetic là một axit yếu dựa trên khả năng phân ly trong dung dịch nước, nhưng axit axetic có tính ăn mòn và hơi của nó gây khó chịu cho mắt và mũi.
Axit axetic là một axit cacboxylic no có chứa hai nguyên tử cacbon trong phân tử của nó và là một dẫn xuất chứa oxi quan trọng của các hiđrocacbon. Công thức phân tử C2H4O₂, công thức cấu tạo CH₃COOH, HAC là viết tắt. Nhóm chức có công thức cấu tạo là nhóm cacboxyl và số CAS là 64-19-7. Vì là thành phần chính của giấm nên nó còn được gọi là axit axetic.
Ví dụ, nó tồn tại chủ yếu ở dạng hợp chất este của nó trong dầu trái cây hoặc thực vật; ở dạng axit tự do trong mô động vật, phân và máu. Giấm thông thường chứa 3% đến 5% axit axetic.
Axit axetic là chất lỏng không màu, mùi hắc. Khối lượng phân tử tương đối là 60,05, điểm nóng chảy là 16,6 ° C, nhiệt độ sôi là 117,9 ° C, tỷ trọng tương đối là 1,0492 (20/4 ° C), tỷ trọng lớn hơn của nước và chiết suất là 1,3716. Axit axetic tinh khiết có thể tạo thành một chất rắn giống như nước đá dưới 16,6 ° C, vì vậy nó thường được gọi là axit axetic băng.
Axit axetic hòa tan trong nước, etanol, ete và cacbon tetraclorua. Khi thêm nước vào axit axetic, tổng thể tích sau khi trộn sẽ nhỏ hơn và mật độ tăng lên cho đến khi tỷ lệ phân tử là 1: 1, tương đương với sự hình thành axit orthoacetic CH3C (OH) ₃, là một axit đơn chức. độ loãng, khối lượng không thay đổi.
Trong các axit cacboxylic, chẳng hạn như axit axetic, các nguyên tử hydro cacboxyl có thể bị ion hóa một phần thành các ion hydro (proton) và giải phóng, dẫn đến tính axit của axit cacboxylic. Axit axetic là một axit yếu đơn bazơ trong dung dịch nước, với hệ số axit là 4,8, pKa = 4,75 (25 ° C), và độ pH của dung dịch axit axetic có nồng độ 1 mol / L (tương tự như nồng độ của hộ giấm) là 2,4, nghĩa là chỉ có 0,4% phân tử axit axetic bị phân ly.
Phương án tính axit của axit axetic: CH3COOH <==> CH3COO- + H +
1. Tác dụng với chất chỉ thị: Có thể làm dung dịch thử quỳ tím chuyển sang đỏ và metyl da cam thành đỏ.
2. Phản ứng với kiềm: CH3COOH + NaOH = CH3COONa + H2O
2CH3COOH + Cu (OH) 2 = Cu (CH3COO) 2 + 2H2O
3. Phản ứng với một số kim loại hoạt động: Mg + 2CH3COOH = Mg (CH3COO) 2 + H2 ↑
Zn + 2CH3COOH = Zn (CH3COO) 2 + H2 ↑
Fe + 2CH3COOH = Fe (CH3COO) 2 + H2 ↑
4. Phản ứng với một số oxit: CaO + 2CH3COOH = (CH3COO) 2Ca + H2O
MgO + 2CH3COOH = Mg (CH3COO) 2 + H2O
PbO + 2CH3COOH = Pb (CH3COO) 2 + H2O
5. Phản ứng với một số muối của axit yếu: 2CH3COOH + Na2CO3 = 2CH3COONa + CO2 ↑ + H2O
2CH3COOH + Na2S = 2CH3COONa + H2S ↑
2CH3COOH + Na2SiO3 = 2CH3COONa + H2SiO3 ↓
CH3COOH + C6H5ONa = C6H5OH (phenol) + CH3COONa
Axit axetic ăn mòn nhiều kim loại, chẳng hạn như sắt, magiê và kẽm, phản ứng tạo thành hydro và axetat kim loại. Thùng nhôm có thể được sử dụng để vận chuyển axit axetic vì nhôm tạo thành một lớp nhôm oxit bảo vệ trên bề mặt của nó trong không khí.
Axetat của kim loại cũng có thể phản ứng với axit axetic và các chất kiềm tương ứng, chẳng hạn như ví dụ nổi tiếng nhất: phản ứng của muối nở với giấm. Ngoại trừ crom (II) axetat, hầu hết tất cả các axetat đều hòa tan trong nước.
Một số phản ứng khác:
CH3COOH + 2O2 → 2CO2 + 2H2O
15CH3COOH + 10NaHCO3 → 10CH3COONa + 2H20 + 20CO2